H. ACHOUR,Y. CHEIKH, K. KAOUN
Service de Prothèse Adjointe - CCTD Casablanca
Faculté de médecine dentaire de Casablanca
Université Hassan II
RÉSUMÉ
L’infection est l’ensemble des troubles qui résultent de la pénétration dans un organisme vivant d’un germe microscopique pathogène qui lui est étranger ou d’une toxine éventuellement produite par ce germe.
Plusieurs études ont montré qu’un grand nombre de maladies peuvent avoir lieu suite à une infection buccale ou une procédure opératoire effectuée au niveau de la cavité buccale. Cette situation laisse supposer l’importance des risques d’infections transmises dans un cabinet dentaire (transmission manu portée, transmission aéroportée).
En prothèse, il existe un lien étroit entre le chirurgien dentiste et le prothésiste dentaire, qui est celui de transfert possible des germes du patient vers le laboratoire, ou inversement vers le cabinet. Il y a là donc danger potentiel de contamination, d’où la nécessité d’établir un plan global de prévention par l’hygiène afin d’optimiser les moyens de lutte face aux risques infectieux professionnels.
Ce Plan d’hygiène devra suivre tout le parcours susceptible d’être contaminé en cours des soins : les mains, les instruments, les équipements, les surfaces, l’air ambiant, le laboratoire de prothèse dentaire.
Mot clés : Infection, prothèse dentaire, prévention.
INTRODUCTION
En dentisterie, l’acte prothétique est certainement un des actes où la rupture de la chaîne d’asepsie est la plus fréquente.
De par la diversité des actes, du matériel et des matériaux mis en jeu, des empreintes qui sont souvent délicates à décontaminer, des différents allers-retours entre le cabinet dentaire et le laboratoire de prothèse. Il est difficile d’avoir une méthode sûre, parfaitement codifiée, comme elle existe pour l’acte chirurgicale (1).
Les méthodes de décontamination, de nettoyage, de désinfection et de stérilisation ont acquis aujourd’hui une importance toute particulière avec le développement de certaines infections tel que le sida.
La salive et le sang contiennent en effet des virus, ainsi que d’autres agents pathogènes impliqués dans différentes maladies bactériennes et virales qualifiées ou non de maladies professionnelles.
Il est donc capital de systématiser ces processus pour tout ce qui a été au contact des liquides biologiques (1).
A ce propos, nous allons décrire la démarche de la prévention du risque infectieux en prothèse qui se fait par :
- L’utilisation de barrières de protection,
- La vaccination,
- La préparation du plan de travail et le travail avec une assistance,
- La stérilisation et la désinfection des instruments, du matériel et des matériaux utilisés en prothèse.
DÉFINITION DE L’INFECTION
L’infection est l’ensemble des troubles qui résultent de la pénétration dans un organisme vivant d’un germe pathogène qui lui est étranger ou de ses toxines (2).
Les principaux germes transmis au cours de la chaîne prothétique
|
Les virus (3,4,5,6,7,8,9 )
|
Les bactéries (3,4,6,7,10)
|
Les champignons (11)
|
|
Le virus du Sida
Le virus de l’hépatite B
Le virus de l’hépatite C
Le virus de l’herpès labial
Le virus de la grippe
Le virus d’Epstein-Barr (VEB)
Le cytomégalovirus (CMV)
|
Les staphylocoques
Les streptocoques
Le bacille de koch
Le pseudomonas
Les klebsielles |
Le Candidas albicans
|
Les modes de transmission (3,6,12)
Au cabinet dentaire, les micro-organismes peuvent être transmis par contact direct ou indirecte via le matériel. Deux modes de transmission sont décrits :
La transmission aéroportée
Elle se fait par inhalation ou par projection de particules septiques, se trouvant dans l’air au niveau de la muqueuse nasale, oculaire ou bronchique.
La transmission manuportée
Elle est assurée par le contact d’objets contaminés ou par la main du praticien.
- Par contact directe, par suite d’atteinte du revêtement cutané (plaies, gerçures, eczéma…) avec le sang, la salive ou par manipulation d’un objet souillé (empreinte, film , radio…)
- Par piqûre ou coupure avec un instrument contaminé.
La contamination croisée en prothèse (3,12,13)
Du faite que l’acte prothétique ne se limite pas au cabinet dentaire mais se propage vers le laboratoire de prothèse, la contamination peut se faire :
- Du patient au praticien,
- Du praticien (ou l’assistant) au patient,
- De patient à patient,
- Du patient au personnel :
• L’assistante encourt les mêmes risques de contamination que le praticien lorsqu’elle travaille au fauteuil,
• La femme de ménage peut être contaminée par le contact avec les aérosols septiques qui ont été distribués tout autour du fauteuil lors des soins,
• Le prothésiste peut être contaminé par les empreintes et les prothèses contaminées par le sang et la salive.
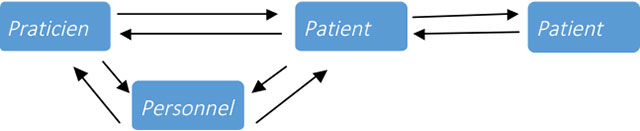 Schéma 1 : La contamination croisée en prothèse. |
La prévention du risque infectieux en prothèse
L’acte prothétique reste particulier car il met en jeu un matériel important et des produits spécifiques qu’il n’est pas toujours facile de décontaminer. De plus, les risques de contamination croisée sont très importants entre la clinique et le laboratoire.
Dans ce paragraphe, des mesures élémentaires de prévention du risque de contamination seront proposées :
• L’utilisation de barrières de protection,
• La vaccination,
• La préparation du plan de travail et l’assistance au fauteuil,
• La stérilisation et la désinfection des instruments, du matériel et des matériaux utilisés en prothèse.
L’utilisation de barrière de protection (6,14,15)
Elles doivent être utilisées de manière systématique par toute l’équipe soignante : praticien, assistante, prothésiste. Il s’agit de protection entre les opérateurs et l’opéré par le port de blouse ou tenue professionnelle, de callot, de masque et de lunettes de protection ou de la visière.
La vaccination (6,14,16,17,18)
C’est une méthode de prévention sûre et efficace. Il est vivement recommandé de tenir à jour un carnet vaccinal. En prenant soin de noter les dates des primo-infections ainsi que les dates de rappels et leur périodicité. Certains vaccins sont obligatoires et d’autres facultatifs mais recommandés.
Les vaccins obligatoires :
• Diphtérie,
• Tétanos,
• Poliomyélite,
• Hépatite B,
• Typhoïde,
• Tuberculose.
Les vaccins recommandés
• Coqueluche,
• Grippe,
• Rougeole,
• Varicelle.
La préparation du plan de travail et l’assistance au fauteuil (1,19,20,21)
Ils permettent de réduire au maximum le risque de contamination.
Pour réduire les manipulations et les déplacements pendant les soins, il faut préparer le plan de travail. Tout ce qui est nécessaire au traitement doit être prêt avant l’arrivée du patient.
Il semble donc indispensable de programmer parfaitement les séances de prothèse. Pour mettre en place cette méthode, il est nécessaire de codifier les actes les plus courants et même de faire des fiches par actes en notant les instruments, le matériel et les matériaux nécessaires.
L’assistance au fauteuil est un point essentiel dans la réduction de la contamination au cabinet. En effet, les mains du praticien sont en contact avec les muqueuses, la salive et le sang du patient, elles ne doivent en aucun cas se déplacer pour manipuler les flacons, boites ou autres emballages contenant des matériaux.
L’intervention de l’assistante est donc indispensable au cours du travail du dentiste (Spatulation du matériau à empreinte et remplissage du porte empreinte, préparation du ciment de scellement….).
La stérilisation et la désinfection des instruments, du matériel et des matériaux utilisés en prothèse
La stérilisation est la mise en œuvre d’un ensemble de méthodes et de moyens visant à éliminer tous les micro-organismes vivants c'est-à-dire l’arrêt irréversible de toute capacité de multiplication microbienne et virale.
La désinfection ou la décontamination est une opération au résultat momentané qui permet d’éliminer ou de tuer ou encore d’inhiber les micro-organismes indésirables. La désinfection s’obtient par l’effet de la chaleur ou par l’application de produits spécifiques (désinfection chimique) (1).
Malheureusement en prothèse, tous les matériaux et matériels ne peuvent être stérilisés. Dans ce paragraphe, nous allons détailler la procédure de décontamination et de stérilisation :
• Des instruments,
• Des empreintes,
• Des portes empreintes individuels,
• Des cires et les matériaux thermoformables,
• Des prothèses.
Les instruments
Les instruments en prothèse se divisent en trois :
- Les instruments jetables,
- Les instruments stérilisables,
- Les instruments désinfectés.
Les instruments jetables (14,19,22,23,24)
L’emploi de matériel jetable à usage unique est le meilleur moyen de réduire la contamination croisée au cabinet dentaire. Il existe aujourd’hui une large gamme de produits à usage unique :
- Instruments d’examen ;
- Canules d’aspiration ;
- Embouts pour la seringue air / eau ;
- Pince pour papier à articuler ;
- Instruments rotatifs…
Malheureusement, le prix encore élevé de ce matériel freine la généralisation de son utilisation au cabinet.
Les instruments stérilisables (1,14,22,25)
Les instruments comme :
• Couteau à cire,
• Spatule à cire,
• Portes empreintes métalliques,
• Fourchette de l’arc facial,
• Plan de fox…
Ces instruments doivent subir la chaîne normale de stérilisation :
• Etape 1 : Pré-désinfection
Elle consiste à plonger les instruments contaminés dans une solution désinfectante et détergente efficace (Fig.1).
 Fig 1 : La pré-désinfection des instruments dans un bac contenant un décontaminant. |
 Fig 2 : Le nettoyage mécanique manuel des instruments.
|
• Etape 2 : Nettoyage
Le nettoyage peut s’effectuer soit manuellement, soit aux ultrasons ou par la machine à laver (Fig. 2 et 5).
 Fig 3 : Le rinçage abondant sous l’eau courante. Fig 3 : Le rinçage abondant sous l’eau courante. |
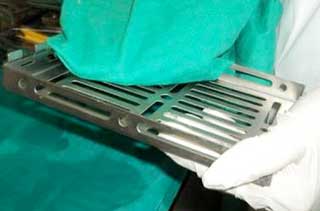 Fig 4 :Le séchage manuel avec un champ en tissu stérile. Fig 4 :Le séchage manuel avec un champ en tissu stérile. |
• Etape 3 : Rinçage
Les instruments doivent être rincés abondamment sous l’eau courante afin d’éliminer tout résidu (Fig. 3).
• Etape 4 : Séchage
Les instruments doivent être placés sur une serviette de tissu et essuyés par une autre serviette car toute trace d’eau peut tâcher, rouiller ou émousser l’instrument. Au cours de cette étape, les instruments sont vérifiés quant à la qualité de leur nettoyage, leur utilisation et ils sont entretenus (Fig. 4).
 |
|
• Etape 5 : Emballage ou conditionnement
Les instruments sont placés en respectant l’effet d’ombre pour que la chaleur et la vapeur les atteigne partout lors de la stérilisation dans des sachets ou des boites perforées ou encore dans des champs pliés et scotchés avant d’être stérilisés à l’autoclave.
A ce stade, il ne faut pas oublier de mettre dans l’emballage les témoins de stérilisation (Fig.6, 7 et 8).
 Figure 6,7 et 8 : Le conditionnement dans un sachet afin de conserver les instruments à l’état stérile.
|
• Etape 6 : La stérilisation
La stérilisation à la vapeur d’eau est la méthode retenue au cabinet dentaire, elle se fait par l’autoclave (Fig. 9 ).
 Fig 9a : L’autoclave dans une structure hospitalière.
|
|
 Fig 9 b : L’autoclave dans un cabinet. Fig 9 b : L’autoclave dans un cabinet.
|
|
 Fig 10 : Changement de couleur des témoins de stérilisation après le cycle de stérilisation.
|
|
L’efficacité de la stérilisation et sa qualité peuvent être contrôlées par les indicateurs :
- Les indicateurs physiques : contrôlent la température, la pression et la durée d’un cycle. Ils peuvent exister sous forme de voyants lumineux sur la porte du stérilisateur,
- Les indicateurs chimiques : Témoins colorés de virage thermique. Ils existent à la surface des sachets de stérilisation,
- Les indicateurs physico-chimiques : Intégrateurs de la stérilisation, ils indiquent que le matériel a été effectivement stérilisé,
- Les indicateurs biologiques : comportent deux espèces bactériennes les plus résistantes à la chaleur.
• Etape 7 : Rangement
Les dates de stérilisation sont marquées sur les boites ou sachets et portées sur un registre accompagné des tests de stérilisation et ce pour assurer une traçabilité.
Enfin les sachets ou boites sont rangés dans un lieu à l’abri des poussières et du risque de contamination.
Les instruments désinfectés (14,26)
Les instruments comme :
• Bol à plâtre ou à alginate,
• Porte empreinte en plastique,
• Lampe à alcool,
• Articulateur,
• Arc facial,
• Teintier.
On utilise soit la technique spray- essuyage- spray ou immersion dans une solution à base d’alcool, d’hypochlorite, d’idophore, phénol ou glutaraldéhyde.
Les empreintes
La méthode de décontamination va varier en fonction du matériau à empreinte utilisé sauf dans la première étape qui consiste à la rincer sous l’eau courante.
Le rinçage doit être effectué immédiatement après le retrait de la cavité buccale, sous l’eau courante jusqu’à disparition totale des traces de sang, de salive et d’autres matières organiques. Ce rinçage simple est considéré le plus important pour la décontamination, car il réduit la contamination de 90% en 15 secondes (1,19,27,28).
Les hydrocolloïdes irréversibles ou alginates (1,27,28,29,30)
A cause de leurs propriétés hydrophiles, les alginates sont perméables et donc difficilement décontaminables. Pour ce type de matériau, il faut trouver un compromis entre un traitement efficace et acceptable du point de vue bactériologique et respectant leurs propriétés physico-chimiques.
La décontamination se fait soit par :
- Pulvérisation de solution à base de glutaraldéhydes à 2%, d’hypochlorite de sodium à des concentrations variant de 0,5 à 5% ou par des mélanges d’alcool et d’aldéhyde ou de dérivés iodés,
- Immersion moins de 10minutes dans ces solutions,
- En comparant les avantages et les inconvénients de ces deux méthodes, la technique qui nous semble la mieux adaptée à ce type d’empreinte (méthode intermédiaire) consiste à :
• Nettoyer l’empreinte sous l’eau courante puis la secouer pour éliminer les excès d’eau ;
• Immerger quelques secondes l’empreinte dans une solution d’hypochlorite de sodium à 0,5 % ;
• Envelopper à l’aide d’une gaze ou d’un papier absorbant l’empreinte qui sera pulvérisé à l’aide d’un spray imbibée de la même solution ;
• Mettre l’empreinte traitée dans un sachet en plastique hermétiquement fermé pendant 30 minutes ;
• La rincer ensuite sous l’eau froide afin d’éliminer toute la solution désinfectante ;
• La secouer ;
• Mettre l’empreinte dans un sachet stérile hermétiquement fermé ;
• Mettre l’ensemble dans une boite et l’envoyer au laboratoire.

Fig 11 : Rinçage abondant de l’empreinte sous l’eau courante.
|
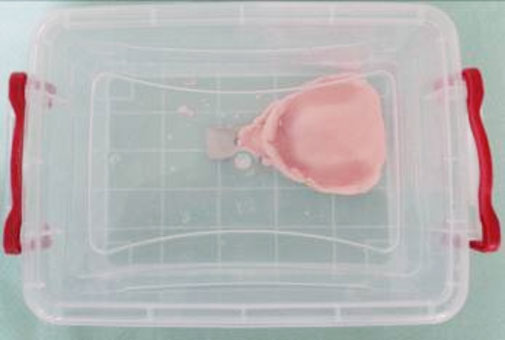 Fig 12 : Immersion de l’empreinte dans une solution d’hypochlorite de sodium à 0,5% pendant moins de 10 minutes.
|
|
Fig 13 : Rinçage sous l’eau courante afin d’éliminer toute la solution désinfectante. |
Fig 14 : Mise en place de l’empreinte dans un sachet stérile puis dans une boite.
|
Les silicones (1,19,28,31,32,33)
Toutes les familles de silicones sont formées de matériaux d’empreinte hydrophobes. Ils retiennent de ce fait moins les micro-organismes. Leur décontamination est donc plus simple et surtout beaucoup moins controversée que celle des hydrocolloides.
La méthode de décontamination des empreintes en silicone doit passer par les étapes suivantes :
• Rincer l’empreinte sous l’eau courante pendant au moins 15 secondes (Fig. 15) ;
• Sécher légèrement l’empreinte afin d’éliminer les excès d’eau (Fig. 16) ;
• Immerger l’empreinte dans un bac fermé pendant 30 minutes dans une solution à 2 % de glutaraldéhyde ou à 0,5 % d’hypochlorite de sodium (Fig.17) ;
• Rincer à nouveau l’empreinte sous l’eau courante (Fig. 18) ;
• Sécher l’empreinte (Fig. 19) ;
• Mettre l’empreinte dans un sachet stérile hermétiquement fermé (Fig. 20) ;
• Mettre l’ensemble dans une boite et l’envoyer au laboratoire (Fig. 21).
Pour les patients à hauts risques, l’immersion doit être prolongée jusqu’à 2 heures. C’est la raison pour laquelle, lorsqu’il y a un risque connu, seules les empreintes en silicone doivent être recommandées.
|
|

Fig 16 : Séchage de l’empreinte. |
|
|
|
 Fig 18 : Rinçage sous l’eau courante afin d’éliminer toute la solution désinfectante. Fig 18 : Rinçage sous l’eau courante afin d’éliminer toute la solution désinfectante. |
 Fig 19 : Séchage de l’empreinte. Fig 19 : Séchage de l’empreinte. |
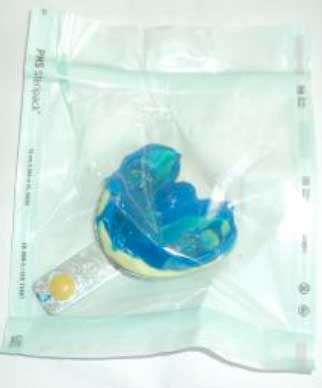 Fig 20 : Mise en place de l’empreinte dans un sachet stérile. Fig 20 : Mise en place de l’empreinte dans un sachet stérile. |

Fig 21: Mise en place de l’ensemble dans une boite. |
Les polysulfures (1,19)
Ces matériaux sont comme les silicones hydrophobes. Donc, ils peuvent subir la même méthode de traitement que les empreintes au silicone.
 Fig 22 : Rinçage abondant de l’empreinte sous l’eau courante. Fig 22 : Rinçage abondant de l’empreinte sous l’eau courante. |
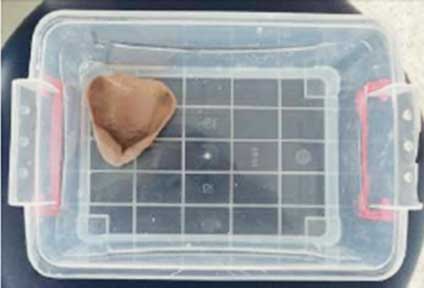
Fig 23: Immersion de l’empreinte dans une solution de glutaraldéhyde à 2 % pendant 30 minutes. |
 Fig 24 : Rinçage sous l’eau courante afin d’éliminer toute la solution désinfectante. Fig 24 : Rinçage sous l’eau courante afin d’éliminer toute la solution désinfectante. |
 Fig 25 : Mise en place de l’empreinte dans un sachet stérile puis dans une boite. Fig 25 : Mise en place de l’empreinte dans un sachet stérile puis dans une boite. |
Les polyéthers (19,28,33,34,35)
L’empreinte au polyéther doit donc être décontaminée par pulvérisation avec une solution à base de glutaraldéhyde à 2 % ou d’hypochlorite de sodium à 0,5 %. La méthode intermédiaire proposée pour les alginates peut parfaitement être utilisée pour ce type de matériau d’empreinte.
L’oxyde de zinc eugénol (19)
L’oxyde de zinc eugénol ne subit pas de modification avec le glutaraldéhyde, alors que l’hypochlorite de sodium est à proscrire.
L’empreinte doit donc être décontaminée par immersion dans une solution à base de glutaraldéhyde à 2 % pendant une durée allant de 10à 60 minutes.
| Matériaux à empreinte | Méthodes | Produits utilisés |
| Hydrocolloides irréversibles: alginate |
Pulvérisation 60mn pour dérivés iodés, 10 à 30 pour les autres. Immersion: - qq. secondes dans une solutions d’hypochlorite - 15minutes pour les autres solutions. |
Glutaraldéhyde à 2%, 2,5% Hypochlorite à 2%, 1%, 5,25% Mélange d’alcool et d’aldéhyde Dérivés iodés |
|
Silicone polymérisant par condensation |
Immersion 15 mn |
Produit à base d’aldéhyde Glutaraldéhydes à2% Hypochlorite (10000ppm chlorine) Dérivés iodés |
| Silicone polymérisant par addition |
Immersion 10mn 15 mn 60 mn |
|
| Polysulfures | Immersion 10 à 60 minutes |
Glutaraldéhyde à 2% Hypochlorite (10000ppm chlorine) Dérivés iodés |
| Polyéthers | Pulvérisation Immersion qq secondes et pulvérisation d’hypochlorite |
Solution à base de glutaraldéhyde à 2 % Hypochlorite de sodium à 1 % |
| Oxyde de Zinc eugénol | Immersion 10 à 60 minutes |
Glutaraldéhydes 2% |
Tableau 1 (36)
Même si le traitement des empreintes a été fait correctement, les risques de contamination croisée ne sont pas totalement éliminés ; c’est la raison pour laquelle les modèles de travail doivent aussi subir un traitement de décontamination au cours et après leur élaboration.
• Au cours de l’élaboration (1) :
Incorporation d’une solution décontaminante au mélange liquide/ poudre.
• Après l’élaboration (1) :
La décontamination des modèles de travail peut se faire soit en :
- Vaporisant une solution d’hypochlorite de sodium à 0,5 % ;
- Immergent les modèles pendant 10 minutes dans la même solution ;
- Utilisant une solution de sulfate de calcium saturée et d’hypochlorite de sodium à 5, 25% ;
- Mettant le modèle à 100c° pendant 15 minutes dans un four.
Les portes empreintes individuels (19,26)
- Rinçage à l’eau courante,
- Immersion ou spray d’une solution d’hypochlorite ou phénol.
Les cires et les matériaux thermoformables (1,19,26)
Comme pour les empreintes, les cires doivent être rincées à l’eau courante, avant d’être décontaminées pour éliminer la salive et les éventuels débris organiques.
Les cires ne pouvant pas subir une stérilisation à la chaleur, on utilise des solutions désinfectantes. Cependant, les substances à base d’alcool sont à proscrire car l’alcool est un solvant des cires ; son utilisation réduirait la précision des enregistrements.
L’association dentaire Américaine recommandait en 1992, l’utilisation d’une solution à base d’iodophores en spray.
Le protocole est le suivant : rinçage- pulvérisation- rinçage- pulvérisation.
Le matériau est ensuite enfermé dans un sachet de plastique scellé pendant le temps recommandé par le fabricant.
Les prothèses
Les prothèses sont généralement contaminées par le sang et la salive. De ce fait, elles doivent faire l’objet d’une désinfection efficace dans le but de limiter le risque de contamination du personnel manipulant et de l’environnement.
La prothèse totale (19,26,36)
La stérilisation par la chaleur des résines est impossible car le matériau subit des distorsions beaucoup plus importantes. La technique de décontamination est la suivante :
- Rinçage à l’eau courante (Fig. 26),
- Immersion dans l’hypochlorite de sodium à 5,25% ou dans les idophores pendant 5 minutes (Fig. 27),
- Rinçage à l’eau courante (Fig. 28),
- Nettoyage aux ultrasons dans de l’eau distillée,
- Séchage de la prothèse,
- Mettre la prothèse dans un sachet stérile hermétiquement fermé (Fig. 29),
- Mettre l’ensemble dans une boite (Fig. 30).
|
|
|
|
|
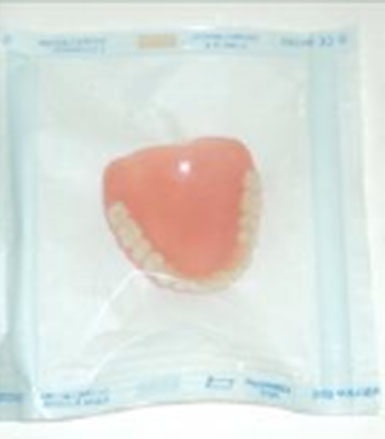
Fig 29 : Mise en place de la prothèse dans un sachet stérile.
|
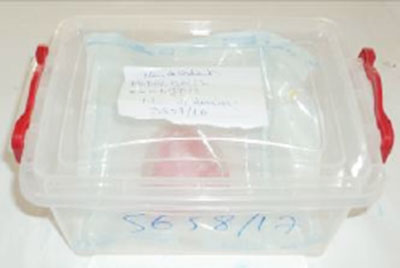 Fig 30 : Mise en place de l’ensemble dans une boite. Fig 30 : Mise en place de l’ensemble dans une boite. |
La prothèse partielle en résine (36,26)
La même technique de décontamination que la prothèse totale mais il faut faire attention à la corrosion des parties métalliques: L’eau de javel est à déconseiller.
La prothèse partielle métallique
• Le châssis métallique (19)
Il doit suivre la chaîne de stérilisation à l’autoclave ou une désinfection à froid par immersion dans l’alcool 70%.
• La prothèse partielle métallique entière (26)
- Rinçage à l’eau courante,
- Immersion dans une solution à base de dérivés iodés,
- Rinçage à l’eau courante,
- Nettoyage aux ultrasons dans de l’eau distillée,
- Séchage de la prothèse,
- Mettre la prothèse dans un sachet stérile hermétiquement fermé.
Les couronnes
Les couronnes métalliques (19)
Elles doivent suivre la chaîne de stérilisation à l’autoclave ou une désinfection à froid par immersion dans l’alcool 70%.
Les couronnes en résine (26,36)
- Rinçage à l’eau courante,
- Immersion ou spray d’une solution d’hypochlorite ou phénol,
- Rinçage à l’eau courante,
- Nettoyage aux ultrasons dans de l’eau distillée,
- Séchage des couronnes,
- Mettre les couronnes dans un sachet stérile hermétiquement fermé.
Les couronnes céramiques (19)
Elles doivent suivre la chaîne de stérilisation à l’autoclave ou une désinfection à froid par immersion dans l’alcool 70%.
CONCLUSION
Le respect de l’hygiène et de l’asepsie dans un acte prothétique est un comportement et un état d’esprit. Tout patient doit être considéré comme potentiellement contaminant quelle que soit sa sérologie.
Dans le but de protection du patient et du personnel soignant (patient, praticien, prothésiste), tous les instruments et les artifices prothétiques (empreintes, prothèse, porte empreinte…) doivent avant d’être livrés au cabinet dentaire ou au laboratoire de prothèse subir un traitement de stérilisation ou de décontamination et être mises dans des sachets étanches. Il vaut mieux prévenir que guérir.
BIBLIOGRAPHIE
1- Patrick Missika, Guillaume Drouhet
Hygiène, asepsie, ergonomie. Un défi permanent.
Collection JPIO, Edition CdP 2001
2- Dictionnaire Larousse
3- Mouluquet M.
Les risques au quotidien les moyens de les éviter.
Inf.Dent., 13 Octobre 1988, 35, 3353-3388.
4- Samaranayake LP ., Scheutz F. , Cottone JA.
La maîtrise de la contamination au cabinet dentaire.
Paris :Ed.Masson. , 1993 : 18-102.
5 - Szpirglas H.
VIH-Sida : Le praticien, le cabinet, le patient.
Aboutostomatol. , 1989, 168, 845-856
6- Thomas 0. , Maiza L.
Transmission des maladies infectieuses.
Encycl.Med.Chir. , 23- 841-B-10, 1998 : 1- 10
7- Cadario Nobert.
L’hygiène au laboratoire.
Art. Tech.Dent, 2002, 13 (1) : 31-34
8- En direct d’internet
Hépatites A/B/C/D quoi de neuf
Esp.Med., mars 1997, 4 (28) : 169-171
9- La santé du prothésiste : Prévention et communication
Edition BTM Prothésiste 2004 -2006
10. Egusa H, Watamoto T, Abe K, Kobayashi M, Kaneda Y, Ashida S, Matsumoto T, Yatani H.
An analysis of the persistent presence of opportunistic pathogens on patient-derived dental impressions and gypsum casts.
Int J Prosthodont. 2008 Jan-Feb;21(1):62-8.
11- Hart Tomy, Shears Paul
Atlas de poche de microbiology
Paris: Ed. Flammarion medicine-science 75006 pp: 74-79/227-229
12- Grimoud A.M, Duffaut-Lagarrigue D.
Hygiène : structure, matériels, méthodes
Encycl. Med. Chir. , 23-815-A-10, 1994 : 1- 21
13- Resmondrichard F., Marc B.
Aérocontamination en pratique dentaire : risques spécifiques et moyens de prévention.
Aboutostomatol. , 1989, 168 : 857-862
14- Guide de prévention des infections liées au soin en chirurgie dentaire et en stomatologie
Ministère de la santé et des solidarités : direction générale de la sante
Conseil supérieur d’hygiène publique de France : comité technique national des infections nosocomiales et des infections liées aux soins : deuxième édition, juillet 2006
15- Ficarra G.
Sida en odontostomatologie.
Paris : Ed. Masson. , 1990 : 37-39.
16- guide de vaccination
Direction générale de la santé France : Comité technique des vaccinations. Ed 2012
17- Catherine Goujo.
Calendrier vaccinal et rappel
Inf. Dent. , 2001, 11.
18- Journal Officiel du 21 Janvier 1991
A propos des vaccinations obligatoires pour les praticiens
Inf. Dent. , Avril 1991, 16.
19- Maxime Helfer, Sandrine Del Fabbro
Asepsie en prothèse au cabinet dentaire
Profession Assistante Dentaire : novembre - décembre 2015
20- Maestroni F.
La pratique de l’asepsie dans l’exercice des spécialités odonto-stomatologiques.
Aboutostomatol. , 1989, 168, 797-808
21- Miara P.
Hygiène et asepsie en prothèse
Paris : Ed. CDP, 2001 : 103-111.
22- Benyahya I., Bennani M., Tahiri S.
Hygiène et asepsie au cabinet dentaire: réalités marocaines.
Esp. Med., 2000, 59 : 7-15
23- François F.
Hygiène et asepsie durant les actes prothétiques
Art. Tech. Dent. , 1997, 3, 129-137
24- Gavalda Gilles, Francart M.
L’hygiène et l’asepsie au cabinet dentaire.
Inf. Dent. , avril 2001, 15, 1115-1118.
25- Mohssine BAGUI, Leila FAJRI, Bouabid EL MOHTARIM, Nadia MERZOUK
La gestion du risque infectieux en implantologie
AOS, 269 ,Septembre 2014
26- Hue O., Berteretche MV.
Le laboratoire
Prothèse complète, Quintessence international, pp : 263-280
27- Benkaddour A., Regragui S., Aalloula E.
Décontamination des empreintes en orthopédie dento-faciale.
Journal Web du dentiste : Mars 2009.
28- Philippe Rocher
Hygiène, asepsie et stérilisation : chronologie d’une journée d’assistante.
LE FIL DENTAIRE, N°25 ,septembre 2007
29- Al-Jabrah O, Al-Shumailan Y, Al-Rashdan M.
Antimicrobial effect of 4 disinfectants on alginate, polyether, and polyvinyl siloxane impression materials.
Int J Prosthodont. 2007 May-Jun;20(3):299-307.
30 - Hussain SM, Tredwin CJ, Nesbit M, Moles DR.
The effect of disinfection on irreversible hydrocolloid and type III gypsum casts.
Eur J Prosthodont Restor Dent. 2006 Jun;14(2):50-4.
31- Jagger DC, Vowles RW, McNally L, Davis F, O'Sullivan DJ.
The effect of a range of disinfectants on the dimensional accuracy and stability of some impression materials.
Eur J Prosthodont Restor Dent. 2007 Mars, 15 (1)
32- Schwartz R.C, Hensley D.H., Bradley D.V.
Immersion disinfection of irreversible hydrocolloid impressions in ph-adjusted sodium hypochlorite. Part1 :microbiology. Int J Prosthodont. 1996 ;ç :217-222
33- Walker MP, Rondeau M, Petrie C, Tasca A, Williams K.
Surface quality and long-term dimensional stability of current elastomeric impression materials after disinfection.
J Prosthodont. 2007 Sep-Oct;16(5):343-51. Epub 2007 Jun 9.
34- Martin N, Martin MV, Jedynakiewicz NM.
The dimensional stability of dental impression materials following immersion in disinfecting solutions.
Dent Mater. 2007 Jun;23(6):760-8. Epub 2007 Mar 13.
35- Yilmaz H, Aydin C, Gul B, Yilmaz C, Semiz M.
Effect of disinfection on the dimensional stability of polyether impression materials.
J Prosthodont. 2007 Nov-Dec;16(6):473-9. Epub 2007 Aug 29.
36- Muller M., Bolla M.
Décontamination des empreintes.
Aboutostomatol . , Mars 1995, 189 : 51-68



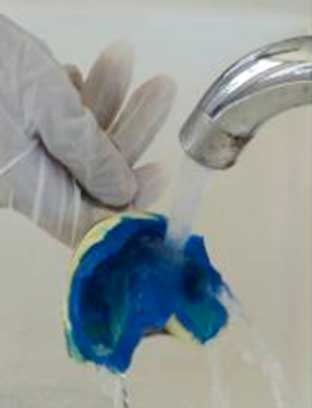 Fig 15 : Rinçage abondant de l’empreinte sous l’eau courante.
Fig 15 : Rinçage abondant de l’empreinte sous l’eau courante. Fig 17: Immersion de l’empreinte dans une solution de glutaraldéhyde à 2 % pendant 30 minutes.
Fig 17: Immersion de l’empreinte dans une solution de glutaraldéhyde à 2 % pendant 30 minutes.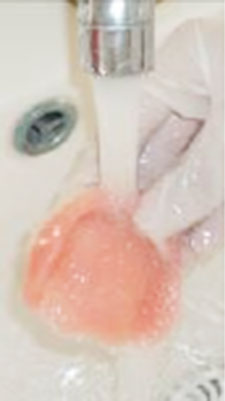 Fig 26 : Rinçage à l’eau courante.
Fig 26 : Rinçage à l’eau courante. Fig 27 : Immersion dans l’hypochlorite de sodium à 5,25% pendant 5 minutes.
Fig 27 : Immersion dans l’hypochlorite de sodium à 5,25% pendant 5 minutes. Fig 28: Rinçage à l’eau courante.
Fig 28: Rinçage à l’eau courante.






