J. DAKKAKI, I. BENKIRANE, M. KARAMI, A. EL OUAZZANI
Service d’Odontologie Conservatrice - CCTD Ibn Rochd. Casablanca
Faculté de médecine dentaire de Casablanca
Université Hassan II
RÉSUMÉ
L’objectif principal de tout traitement endodontique des dents infectées est d’éliminer les microorganismes qui colonisent le réseau canalaire. Cette désinfection repose essentiellement sur une préparation chimio-mécanique où les limites des instruments endodontiques, qui mettent en forme le canal principal, sont palliées par les solutions d’irrigation.
Ces dernières nettoient l’ensemble du système canalaire à condition de respecter une séquence opératoire correcte dans un cadre aseptique. Celle-ci commence par une irrigation dès l’ouverture de la cavité d’accès, pendant la mise en forme canalaire et à la fin de la préparation canalaire afin d’enlever les boues dentinaires générées par l’action des instruments de mise en forme.
Cette action est permise par l’association de l’hypochlorite de sodium à 2,5% et un chélateur à base d’EDTA (Acide éthylène diamine-tétracétique). Pour des raisons cliniques, l’obturation endodontique ne peut être envisagée dans la même séance, du fait de la présence d’une symptomatologie aigue ou la difficulté d’obtenir un canal sec, ce protocole opératoire est complété par la mise en place d’une médication canalaire en inter-séance à visée antiseptique et réparatrice, type hydroxyde de calcium.
Mots clés : Irrigation endodontique, Désinfection endodontique, Hypochlorite de Sodium, EDTA, Traitement endodontique, Mise en forme canalaire, Champ opératoire, Solutions d’irrigation, Hydroxyde de Calcium.
Dans la pratique quotidienne, le praticien est souvent confronté au traitement des dents nécrosées associées ou non aux parodontites apicales. Ces lésions représentent un problème de santé public majeur et largement sous estimé dans de nombreux pays. En effet, à l’exception des travaux d’Eriksen et de Marquès (Tableau 1) qui évoquent des faibles proportions de sujets atteints de lésions apicales, l’ensemble des études soulignent leur très forte prévalence (1).
En fait, ces lésions sont induites par les bactéries et leurs produits dérivés. Ceci a été clairement démontré par Miller il y’a plus d’un siècle. En effet, la pulpe nécrosée ne possède pas le potentiel immunogène pour déclencher l’apparition d’une parodontite apicale. Cependant, elle constitue un excellent substrat pour le développement des microorganismes.
La plupart du temps, ces bactéries restent confinées à l’intérieur de l’espace endodontique, tandis que les produits de dégradation peuvent passer facilement au-delà de la constriction apicale. Ainsi, l’objectif principal du traitement de la dent infectée est de contrôler et d’éradiquer l’infection. Les moyens actuellement disponibles sont représentés essentiellement par l’irrigation endodontique et la médication intracanalaire antiseptique dont l’efficacité est autorisée par une bonne mise en forme canalaire.
Cet article passe en revue les différents paramètres à respecter et les différents produits utilisés afin d’obtenir une désinfection optimale et propose les différentes approches thérapeutiques en fonction des situations cliniques.
| Auteurs | Année de publication | pays | Radiographies analysées | Prévalence de la parodontite périapicale |
|
Allard U. et coll.
Eckerbom M et coll.
Eriksen H.M. et coll.
Petersson K. et coll.
De Cleen M.J.H. et coll.
Saunders W.P. et coll.
Marques M.D. et coll.
De Moor R.J.G. et coll.
Boucher Y. et coll.
Jiménez-Pinzon A. |
1986
1987
1988
1989
1993
1997
1998
2000
2001
2003
|
Suède
Suède
Norvège
Suède
Pays-Bas
Royaume-Uni
Portugal
Belgique
France
Espagne |
BLC
BLC
Pano
BLC
Pano
Pano
Pano
Pano
BLC
BLC
|
72%
63%
30%
77%
45%
68%
26%
73%
63%
61%
|
| BLC : Bilan long cône, Pano : Panoramique | ||||
Tableau 1 : Prévalence des parodontites apicales dans la plupart des pays d’Europe (1)
LA FLORE BACTERIENNE D’UN RÉSEAU CANALAIRE INFECTÉ
La nature de la flore bactérienne conditionne le choix des solutions d’irrigation et les pansements en inter-séances. On peut souligner la présence d’une flore bactérienne essentiellement anaérobie dont la composition varie en fonction de la forme de la pathologie péri-apicale et le moment d’apparition de l’infection. Ces bactéries se présentent sous forme de biofilms dont l’organisation structurelle est sous la forme d’une matrice intercellulaire au sein de laquelle sont retrouvées les bactéries. Cette organisation confère à la flore endodontique une résistance aux substances antibactériennes. En effet, les études in vitro de biofilms mono-espèce ont démontré que les bactéries sous cette forme sont plus résistantes que les bactéries sous forme planctonique (2). Quant aux études reproduisant la formation de biofilms à deux espèces, elles ont montré une résistance encore plus accrue (3).
Par ailleurs, on distingue une infection primaire lorsque les bactéries colonisent initialement le tissu pulpaire nécrosé avec une flore à prédominance anaérobies Gram-, et une infection secondaire quand les microorganismes colonisent le réseau canalaire lors d’un traitement endodontique initial ou en inter-séances. Topographiquement, les biofilms bactériens peuvent être classés en biofilm intra-canalaire retrouvé sur les parois dentinaires ou les fibres du tissu conjonctif nécrosé trouvant sur ce support les éléments nécessaires à leur croissance, et biofilm extra-radiculaire retrouvé dans les infections réfractaires. Les germes responsables sont principalement des bactéries appartenant aux espèces Actinomyces, Enterococcus et Propionibacterium.
LA BOUE DENTINAIRE
Aussi connue sous le nom de Smear Layer ou Enduit pariétal, la boue dentinaire est une couche microscopique de débris située à la surface dentinaire qui résulte du contact direct des instruments avec les parois canalaires. Au microscope électronique, elle présente une structure amorphe de 1 à 6 micron d’épaisseur qui peut se compacter sur une profondeur de 60 micron par des petits bouchons ancrés à l’intérieur des tubulis dentinaires. Composée essentiellement de débris de dentine minéralisée, elle se caractérise également par la présence d’une composante organique issue des résidus de tissu pulpaire, des odontoblastes, de prédentine peu calcifiée et de bactéries.
Selon certains auteurs, il est préférable de conserver la boue dentinaire parce qu’elle représente une barrière qui empêche l’infiltration des tubulis dentinaires par les bactéries. Cependant pour d’autres, cette barrière n’est pas hermétique et apparaît sous microscope non homogène. Elle empêche l’adhésion des ciments de scellement canalaires ainsi que l’action des solutions d’irrigation et des médicaments intracanalaires (4).
LES FACTEURS CLÉS D’UNE DÉSINFECTION OPTIMALE
Les règles endodontiques de base sont parfaitement codifiées par la HAS (Haute Autorité de Santé) et incluent :
- Préparation de la dent au traitement : Suppression des caries puis restauration pré-endodontique.
- Mise en forme canalaire par le biais d’une instrumentation.
- Irrigation avec une solution antiseptique et solvante.
- Obturation du réseau endodontique lorsque les conditions optimales sont réunies.
- Suivi clinique et radiographique du traitement dans le temps.
Il est donc nécessaire de respecter ces fondements biologiques afin de s’inscrire dans une démarche thérapeutique la plus fiable possible.
LE CHAMP OPÉRATOIRE : LA DIGUE
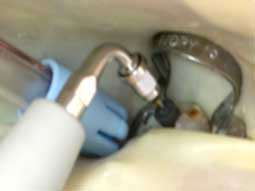
En endodontie, l’utilisation de la digue comme un champ opératoire de référence est incontournable (5). Elle réunit de nombreux avantages que sont l’asepsie, l’ergonomie et la sécurité quant aux risques d’ingestion ou d’inhalation des instruments. Ainsi, en isolant hermétiquement la dent concernée du milieu buccal septique, elle évite les contaminations salivaires et conforte l’irrigation endodontique tout en maintenant l’asepsie du système canalaire au cours de la mise en forme.
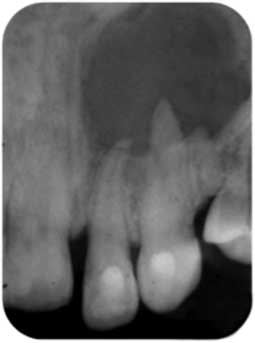
Bien souvent les pertes de substances coronaires sont telles que la stabilité du crampon est difficile à obtenir (Fig 1a). Dans ces cas, la reconstitution pré-endodontique par l’utilisation d’une matrice métallique et d’un ciment verre ionomère ou par la mise en place d’une bague de cuivre permet de rétablir une morphologie coronaire compatible avec la stabilité du crampon et donc l’étanchéité du champ opératoire. Elle permet également l’obtention d’une cavité d’accès à quatre parois qui servira de réservoir pour les solutions d’irrigation ainsi qu’une obturation provisoire de bonne qualité pour éviter les nouvelles contaminations entre les séances (Fig 1b, 1c).
|
|
|
 |
|
LA MISE EN FORME CANALAIRE
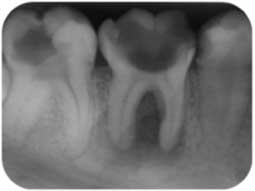
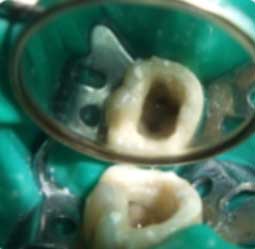
La préparation endodontique se conçoit comme une préparation chimio-mécanique où la mise en forme instrumentale trouve toute sa signification pour influencer la qualité de l’assainissement endodontique. Le plus important réside dans l’obtention d’une conicité régulière et suffisante qui se superpose avec la trajectoire initiale du canal principal, depuis sa partie coronaire jusqu’à la partie apicale (Fig 2a, 2b). Cette conicité, qui permet d’amener les solutions d’irrigation tout au long du canal et en quantités importantes, est obtenue actuellement en utilisant la technique du Crown-Down, aussi appelée préparation corono-apicale.
De nombreux auteurs se sont penchés sur le principe de la mise en forme du tiers apical afin d’éliminer le maximum de bactéries, et il ressort de leurs études qu’il est nécessaire de conserver un diamètre foraminal le plus fin possible et qui correspond au diamètre initial afin d’éviter la propulsion des débris canalaires dans le péri apex et d’assurer l’étanchéité des obturations canalaires qui sont le garant de la cicatrisation apicale (6). Le respect de la longueur du travail est également un facteur clé à privilégier surtout dans les situations où les limites apicales deviennent aléatoires tels les cas de résorptions inflammatoires externes et les apex ouverts.
L’utilisation des instruments en Ni-Ti permet de pallier la rigidité des instruments en acier inoxydable et de contourner les difficultés anatomiques. Ces instruments ont connu des évolutions au fil des années afin d’améliorer les profils et d’avoir une meilleure remontée des débris (7). Cependant, si on fait une petite synthèse de la littérature, il ne semble pas y’avoir une différence entre l’instrumentation manuelle et rotative si l’irrigation est bien menée. En effet, toutes les études soulignent que la technique opératoire reste le moyen le plus important pour atteindre les objectifs biologiques de guérison. En conséquence, pour tous les systèmes qu’ils soient rotatifs ou manuels, l’essentiel est de respecter la séquence opératoire en utilisant les limes de récapitulation et de perméabilité, d’avoir une conicité suffisante en fin de préparation et de renouveler suffisamment l’irrigant.
 |
 |
L’IRRIGATION ENDODONTIQUE
L’état actuel des connaissances privilégie le traitement endodontique en «une seule séance». En conséquence, l’irrigation va jouer un rôle très important et plus que jamais essentielle dans la chaine d’asepsie-antisepsie car, quelque soit le système utilisé, il est impossible d’instrumenter toutes les parois radiculaires (8). Il a été démontré que seulement 55% à 70% des parois d’un canal correctement mis en forme sont concernées par le passage des instruments (9).
De même que ceux-ci, en raison de la complexité du système endodontique, ne peuvent pas accéder aux canaux secondaires et accessoires. De ce fait, l’irrigation complète la préparation mécanique par une action physique de lubrification des canaux, mise en suspension des débris canalaires et une action chimique qui permet de dissoudre les matières organiques, minérales tout en neutralisant les microorganismes et leurs dérivés.
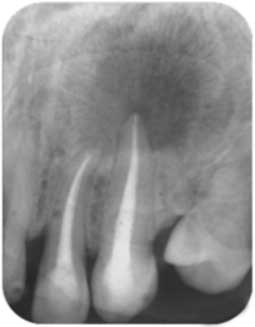
A l’heure actuelle, aucun des produits présents sur le marché ne peut répondre à toutes les qualités requises de l’irrigant idéal. Ainsi, l’association de plusieurs solutions s’impose afin de réaliser le nettoyage et la désinfection la plus complète possible (10, 11, 12). L’hypochlorite de sodium demeure jusqu’à présent l’irrigant de référence en endodontie. Il a une action dissolvante sur les tissus nécrosés et un pouvoir antiseptique largement démontré (13). Cependant, à lui seul, il n’a pas de pouvoir sur le contenu minéral et doit être complété par un déminéralisant (Fig 3a).
Les concentrations recommandées varient entre 0,5% et 5,25% (14,15,16,17). Ces concentrations sont obtenues à partir des dilutions de la solution base ou par l’utilisation des solutions stabilisées type «Parcan» ou «Apiclor». Cependant, la concentration de 2,5% semble être le meilleur compromis entre efficacité et absence de toxicité. Son efficacité dépend également du volume de la solution et son renouvellement dans la mesure où le chlore disponible doit rester toujours en excès par rapport à la quantité de matière à dissoudre (18).
Par ailleurs, Cunningham a montré que l’élévation de la température à 37°C de la solution d’hypochlorite de sodium à 2,5% potentialise son pouvoir solvant et son efficacité devient comparable à celle d’une solution à 5,25% (19).
Les déminéralisants sont utiles dans la mesure où le gel chélatant type Glyde ou RC Prep permet de lubrifier le canal, de faciliter l’utilisation des instruments en Ni-Ti et de faire les négociations en cas de canaux fins ou difficiles où ils peuvent rendre service en ramollissant légèrement la dentine (20, 21). A la fin de la préparation, le rinçage du canal avec un chélatant liquide tel que l’EDTA (Acide éthylène diamine-tétracétique) à 17% permet d’éliminer la boue dentinaire (Fig 3b).
Ainsi, l’association de l’hypochlorite de sodium et l’EDTA s’avère la séquence d’irrigation la plus efficace pour parfaire la désinfection (Fig 4a, 4b). Sur le plan clinique, la séquence opératoire doit viser une irrigation tridimensionnelle. Il convient donc d’avoir une irrigation initiale dès l’ouverture de la cavité d’accès, continue tout au long de la mise en forme canalaire et une irrigation finale afin d’éliminer toutes les boues dentinaires déposées.
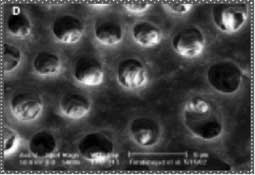
L’EDTA peut être remplacé par une solution désignée sous le nom de MTAD et qui est un mélange de Tétracycline, l’acide citrique et un détergent (Tween 80). Ce chélateur, associé à l’hypochlorite de sodium en rinçage final, a permis une meilleure élimination de la boue dentinaire au niveau du tiers apical tout en conservant la structure des tubulis dentinaires (Fig 5). L’adjonction de Tétracycline et du détergent dans le mélange du MTAD confère à cette solution un pouvoir antiseptique meilleur par rapport à l’EDTA (22,23,24).
|
|
|
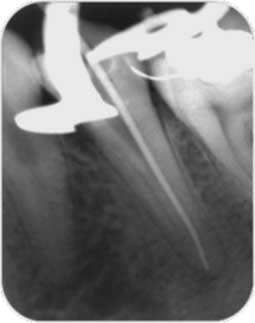
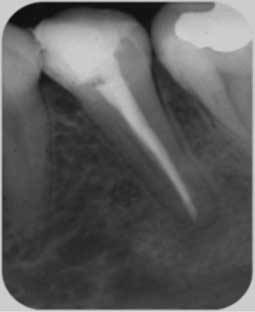
Le transport de la solution à l’intérieur du canal se fait à l’aide des seringues endodontiques avec des aiguilles à perforation latérale qui permettent de créer un courant hydraulique entre l’injection de l’irrigant et son retour vers la région coronaire. La désagrégation du biofilm bactérien dans les zones non instrumentées ne peut se faire que par l’activation de la solution à l’intérieur du réseau canalaire en fin de préparation canalaire, ce qui justifie l’utilisation des limes associées à des unités ultrasonores et dont le diamètre apical correspond au calibre apical obtenu à la fin de la mise en forme (Fig 6a, b, c, d).
Cette activation génère un processus de cavitation à l’origine d’une augmentation de la température de la solution d’irrigation, qui potentialise ses propriétés (25). Selon Pierre Machtout la circulation des solutions d’irrigation est limitée dans le tiers apical et seule l’agitation de la solution à la longueur de travail permet son renouvellement complet. Cette activation peut se faire tout simplement à l’aide d’un cône de gutta animé d’un mouvement de pompage vertical de 4 à 5 mm d’amplitude pendant 1 ou 2 minutes.
|
|
|
|
|
|
|
|
|
 |
 |
LA MÉDICATION EN INTER SÉANCE
Dans certaines situations, telles que l’existence de douleurs préopératoires associées à une parodontite apicale d’origine endodontique, la persistance d’un suintement canalaire ou encore la présence de résorptions radiculaires, la triade endodontique ne peut être bien conduite. D’où l’intérêt de mettre en place des médicaments intracanalaires à des fins antiseptiques. Cette médication ne peut être utilisée qu’après un parage canalaire avec une irrigation suffisante et ne se substitue pas à ces étapes.
Parmi les spécialités proposées dans ce cadre, l’hydroxyde de calcium trouve toute sa place en endodontie pour son effet bactéricide conféré par son pH alcalin et sa capacité biologique de réparation et de reminéralisation. Il agit par un mécanisme chimique impliquant la libération des ions hydroxyles (OH-) qui entrainent une altération de la membrane cytoplasmique, une suppression de l’activité enzymatique des bactéries et une inhibition de la réplication de l’ADN. Toutefois, ces effets ne sont possibles que si la molécule entre en contact avec les bactéries, d’où la nécessité d’introduire le médicament jusqu’au tiers apical. Il agit également par un mécanisme physique en créant une barrière qui prévient l’invasion bactérienne entre les séances et en limitant l’espace pour la multiplication des bactéries résiduelles.
Les premières études scandinaves ont recommandé l’usage obligatoire de ce matériau dans le cas des dents infectées. Ce concept était basé sur l’obtention d’un diamètre apical augmenté à distance du foramen afin de ne pas détériorer cette zone. Ainsi, il persiste une zone non instrumentée d’environ 1mm de longueur, d’où la nécessité pour les adeptes de cette technique d’utiliser une médication placée généralement pendant plusieurs semaines afin d’achever la désinfection et d’obtenir un canal stérile. Ces études datent d’une vingtaine d’années et sont fondées sur des cultures bactériennes où toutes les souches ne peuvent être mises en évidence.
Par ailleurs, les études actuelles basées sur la biologie moléculaire ont comparé l’efficacité de l’hydroxyde de calcium avec celle de l’hypochlorite de sodium. Il ressort de ces données qu’il n’y aurait pas autant d’efficacité qu’on le disait et les résultats seraient les mêmes (26, 27, 28). En effet, l’étude randomisée de Waltimo compare le taux de succès à 12 mois des dents traitées en une ou plusieurs séances et met en évidence que la mise en place de l’hydroxyde de calcium en inter-séance ne s’accompagne pas d’un meilleur taux de succès. En outre, d’autres auteurs ont montré que l’hydroxyde de calcium n’était pas efficace sur Enterococcus Faecalis et que son pH est rapidement neutralisé par les produits bactériens acides et par les phosphates de l’hydroxyapatite de la dentine qui limitent la diffusion des ions H+ et OH- (28).
Par ailleurs, l’obturation tridimensionnelle avec un ciment et la gutta réchauffée permet d’emmurer les bactéries résiduelles les empêchent ainsi de se développer. Selon Shalhav et coll., le relargage d’eugénol des ciments à base d’oxyde de zinc eugénol leur confère un pouvoir bactéricide certain.
Le gel de chlorhexidine à 2% a été également proposé comme médication temporaire. Il possède une action sur les Candida et les bactéries Gram+ par effet de rémanence. En effet, ses molécules chargées positivement s’adsorbent sur la dentine et permettent un relargage de chlorhexidine pendant au moins deux semaines, voire douze semaines, prévenant ainsi toute réinfection du canal au cours de cette période (29).
CE QU’IL FAUT RETENIR POUR LA DÉSINFECTION DES DENTS INFECTÉES :
• Mise en place d’un champ opératoire étanche et aménagement d’une cavité d’accès à quatre parois.
• Irrigation initiale à l’hypochlorite de sodium à 2,5% après ouverture de la cavité d’accès.
• Chaque passage des limes est suivi d’une instillation de 0,5 ml d’hypochlorite de sodium. Les limes de récapitulation permettent d’agiter la solution et de la faire progresser apicalement.
• Chaque lime Ni-Ti est enduite de gel chélatant avant son introduction dans le canal.
• Irrigation finale une fois la mise en forme terminée :
- Irrigation avec 1ml d’EDTA liquide pendant 2minutes, activé aux ultra-sons afin d’enlever la boue dentinaire.
- Rinçage final à l’hypochlorite de sodium suivi d’une activation.
• Si l’obturation endodontique ne peut être achevée dans la même séance (suintement, douleur, anatomie endodontique compliquée), l ’hydroxyde de calcium sera mis en place afin de protéger le système endodontique cotre les contaminations secondaires.
CONCLUSION
Le respect de l’antisepsie est un des objectifs majeurs du traitement endodontique. Ceci implique une méthodologie rigoureuse du traitement qui respecte toute les étapes opératoires, allant d’un champ opératoire étanche et une préparation chimio-mécanique la plus efficace possible jusqu’à la mise en place d’une médication antiseptique qui respecte les indications.
Enfin, l’obturation canalaire canalaire et la reconstitution coronaire étanche permettent de sceller l’endodonte et de maintenir ainsi le résultat obtenu. Les avancées technologiques ont permis aux approches thérapeutiques de privilégier le traitement endodontique en une seule séance. De ce fait, il est inconcevable de ne pas s’inscrire dans une pratique saine.
BIBLIOGRAPHIE
1. Y. BOUCHER. Parodontites apicales et mauvais traitements endodontiques : état d’urgence. Rev Odont Stomat 2005 ; 34 : 205-217.
2. ABDULLAH M., LING N.G.Y., ULABIVALA K.MOLES D.R. Susceptibility of two Enterococcus faecalis phenotypes to root canal medications. J Endo 2005;31(1):30-36.
3. J.S. GOUET. Biofilms bactériens et implications en endodontie. Rev Odont Stomat 2011;40:18-31.
4. Shahravan A, Haghdoost AA, Adl A, Rahimi H, Shadifar F. Effect of smear layer on sealing ability of canal obturation: asystematic review and meta-analysis. J Endod. 2007; 33: 96-105.
5. R. Kaleka. La digue en endodontie : Posez-la, reposez-vous sur elle! Réalités cliniques Vol 17 n°4, 2006 pp. 341-355.
6. I. COCHET. Quelles règles doit-on respecter lors de la préparation canalaire apicale ? Inf.dent, n°37, Oct 2004 : 2427-2430.
7. P. MACHTOU. Deux décennies d’endodontie. Réalités cliniques 2010. Vol. 21, n°1 :41-51.
8. P. MACHTOU, F. BRONNEC. Les objectifs de l’irrigation en endodontie. ALPHA OMEGA NEWS - N° 141 - MAI / JUIN 2011.
9. S. Simon. L’irrigation en endodontie : l’essentiel à connaître à tout prix.Clinic-Fev2011-vol.32.
10. F. BUKIET, C. ROLLAND, N. GARDON, L. POMMEL. Optimiser l’antisepsie canalaire par une irrigation efficace. Réalités cliniques 2006. Vol. 17, n°4 :371-383.
11. G. CANTATORE. L’irrigation de l’endodonte : importance dans le nettoyage et la stérilisation du réseau canalaire. . Réalités cliniques 2001. Vol. 12, n°2 :185-201.
12. G. CARON. L’hypochlorite de sodium en 2008 : Stop ou encore ? Le fil dentaire, n°30, fév 2008 : 18-20.
13. Zehnder M. Root canal irrigants. J Endod. 2006 ; 32 : 389-398.
14. Spangberg L, Engstrom B, Langeland K. Biologic effects of dental materials. 3. Toxicity and antimicrobial effect of endodontic antiseptics in vitro. Oral Surg Oral Med Oral Pathol. 1973; 36 (6) : 856-71.
15. Baumgartner JC, Cuenin PR. Efficacy of several concentrations of sodium hypochlorite for root canal irrigating. J.Endod 1992 Dec; 18 (12): 605-12.
16. Clarkson RM, Moule AJ, Podlich HM.The shelf-life of sodium hypochlorite irrigating solutions. Aust Dent J. 2001 Dec; 46 (4) : 269-76.
17. Clarkson RM, Moule AJ. Sodium hypochlorite and its use an endodontic irrigant. Aust Dent J. 1998 Aug; 43 (4). Review.
18. Siqueira JF , Rôças I, Favieri A, Lima KC . Chemomechanical reduction of the bacterial population in the root canal after instrumentation and irrigation with 1%, 2,5% and 5% sodium hypochlorite. J Endod. 2000; 26: 331-334.
19. Cunningham WT, Joseph SW. Effect of temperature on the bactericidal action of sodium hypochlorite endodontic irrigant Oral Surg Oral Med Oral Pathol. 1980,Dec;50(6):569-71.
20. M.R. Ektefaie. Journal de l’Association dentaire canadienne Juillet/Août 2005, vol. 71 N°7.
21. O’Connell MS, Morgan LA, Beeler WJ, Baumgartner JC. Acomparative study of smear layer removal using different salts of EDTA. J. Endod, 2002 Dec; 26 (12): 739-43.
22. Torabinejad M, Cho Y, Khademi AA, Bakland LK, Shabahanq S. The effect of various concentrations of sodium hypochlorite on the ability of MTAD to remove the smear layer. J Endod. 2003 Apr; 29 (4): 233-9.
23. Giardino L, Savoldi E, Ambu E, Rimondini R, Palezona A, Debbia EA. Antimicrobial effect of MTAD, Tetraclean, Cloreximid, and sodium hypochlorite on three common endodontic pathogens. Indian J Dent Res. 2009 Jul-Sep; 20 (3): 391.
24. Mozayeni MA, Javaheri GH, Poorroosta P, Ashari MA, Javaheri HH. Effect of 17% EDTA and MTAD on intracanal smear layer removal : a scanning electron microscopic study. Aust Endod J. 2009 Apr; 35 (1): 13-7.
25. Tsurumachi T, Takita T, Hashimoto K, Katoh T, Oqiso B. Ultrasonic irrigation of a maxillary lateral incisor with perforation of the apical third of the root. J Oral Sci. 2010 Dec; 52 (4): 659-63.
26. V. DESCROIX, F. BRONNEC, WILHELM-J. PERTOT, F. RILLIARD, K. YASUKAWA, P. ROCHER, M. GOLDBERG, S. KLEINFINGER. Médicaments et dispositifs médicaux en endodontie. Cahier de l’ADF, 2008.
27. Siqueira JF Jr, Guimarães-Pinto T, Rôças IN. Effects of chemomechanical preparation with 2,5% sodium hypochlorite and intracanal medication with calcium hydroxide on cultivable bacteria in infected root canals. J Endod. 2007 Jul;33(7):800-5.
28. G. Caron, P. Machtou. La planification thérapeutique en endodontie: une ou plusieurs visites? Réalités cliniques Vol 17 n°3, 2006 pp. 307-316.
29. Rosenthal S, Spangberg L, Safavi K. Chlorhexidine substantivity in root canal dentin. Oral Surg Oral Med Oral Pathol Radiol Endod. 2004 Oct; 98 (4) : 488-92.