S. BELFELLAH, J. KISSA.
Département de Parodontologie
Faculté de Médecine Dentaire Casablanca - MAROC
Université Hassan II
RÉSUMÉ
La perte biologique des implants peut être causée par une perte progressive de l'ostéo-intégration après la mise en place de la restauration prothétique et sa mise en fonction.
De nombreux éléments ont été incriminés dans la destruction osseuse péri-implantaire, et la perte progressive de l’ostéo-intégration jusqu’à la perte totale de l’implant. Selon le World Workshop de 2018, l’étiologie infectieuse occupe une place importante dans le développement des mucosites et des péri-implantites.
Plusieurs facteurs de risque ont été ainsi rapportés dans la littérature, ils peuvent être d’ordre local ou général. La combinaison des paramètres locaux avec d’autres conditions systémiques prédisposerait davantage à la survenue de maladies péri-implantaires. L’antécédent de parodontite reste un facteur de haut risque. De même le mauvais contrôle de la plaque seul conditionnerait le développement de la péri-implantite.
Mots clés : implant, facteurs de risque, péri-implantite.
INTRODUCTION
Le remplacement dentaire peut être obtenu avec succès grâce aux thérapeutiques implantaires selon Stokman et coll en 2017 (1). Malgré un taux de réussite élevé, le risque de développer des maladies péri-implantaires est toujours omniprésent. Ces dernières sont réparties en mucosite péri-implantaire et en péri-implantite selon le World Workshop en 2018 (2,3).
Ainsi, ces complications biologiques à multiples facteurs de risque, seraient principalement initiées par une implication bactérienne et une réponse excessive de l'hôte (2,4).
DÉFINITION DE LA PÉRI-IMPLANTITE
Berglundh et coll en 2018 (5) définissent la péri-implantite comme étant une inflammation de la muqueuse péri-implantaire associée à une perte progressive de l'os de soutien. L’étendue de la perte osseuse peut indiquer la sévérité de la maladie. Ainsi sans une prise en charge adéquate, la perte de l’implant est fortement redoutée (6).
Cliniquement, les sites affectés de péri-implantite montrent (5) :
- des saignements au sondage avec ou sans suppuration,
- une augmentation de la profondeur du sondage (≥ 6 mm) associée ou non à une récession de la muqueuse marginale,
- une perte osseuse ≥ 3 mm dans la zone la plus coronaire de l’implant intra osseux.
Schwarz et coll en 2018 (7), précisent que ces lésions osseuses sont souvent circonférentielles autour des implants.
PRÉVALENCE DE LA PÉRI-IMPLANTITE
La littérature a révélé une grande variabilité des prévalences.
Selon le 6ème Workshop européen de parodontologie en 2008, Zitzmann et Berglundh (8) ont monté que la péri-implantite a été identifiée chez 28% à 56% des patients et dans 12% à 43% des sites implantaires, respectivement.
D’après la méta analyse de Derks et Tomasi en 2015 (6), la prévalence des péri-implantites est de 22%. Et selon Lee et coll en 2017 (9), 19,83% des patients et 9,25% des implants présentent une péri-implantite.
Récemment, Kordbacheh et coll en 2019 (10) ont montré une prévalence de 21% et de 34% respectivement pour des implants et des patients sur un suivi moyen de 2 ans.
En 2020, selon J.Kissa et coll, la prévalence des péri-implantites est de 41,4% au niveau du patient, et de 22,7% au niveau de l'implant, respectivement. Celle-ci s’accroitrait avec le nombre d'années de suivi (11).
LA PERCEPTION DES MALADIES PÉRI-IMPLANTAIRES PAR LES PATIENTS IMPLANTÉS
L’ évaluation de la perception des risques et de la sécurité du traitement implantaire par Insua et coll en 2017 (12) a révélé que :
- 74,1% des patients implantés n'avaient pas de notions sur les maladies implantaires,
- 64% d’entre eux avaient une inquiétude face à ces maladies,
- 32% des patients qui souffraient de péri-implantites avaient déclaré vivre avec une pathologie «terrible».
Devant un niveau élevé de préoccupation des patients implantés, les auteurs ont souligné l’intérêt d’éclairer préalablement tous les patients candidats à un traitement implantaire sur les risques encourus. Il est donc nécessaire de discuter des causes et des éventuels facteurs de risque qui seraient incriminés dans le développement des péri implantites (12).
LES FACTEURS DE RISQUE DES PÉRI-IMPLANTITES
Ils peuvent être divisés en 2 groupes :
- les facteurs locaux qui seraient liés à la composition du biofilm et à la charge microbienne dans le sulcus péri-implantaire,
- les facteurs généraux qui, influenceraient la sensibilité de l’hôte face à cette infection microbienne (4).
Les facteurs de risque locaux :
1- Le biofilm oral
Il est établi que le biofilm bactérien qui colonise les surfaces implantaires serait le facteur étiologique déterminant dans le développement des infections autour des implants telles que les mucosites et les péri-implantites (4,13).
- • Évolution des sites implantaires sains vers des sites pathologiques
Les données de la revue de Schwarz et coll en 2018 (7) montrent que, comparativement à un site sain, la péri-implantite était associée à plus de 19 espèces bactériennes dont Porphyromonas gingivalis et Tannerella forsythia.
Aussi, il y aurait plus de pathogènes opportunistes tels que Pseudomonas aeruginosa, Staphylococcus aurus, et Candida albicans (7).
Le virus d'Epstein-Barr était également retrouvé très fréquemment selon une méta analyse récente de 2019 de Akram et coll (14). Ces données indiquent qu’il s’agit d’une infection complexe et hétérogène telle qu’elle a été précédemment définie par Mombelli et Décaillet en 2011 (15) et confirmée ensuite par Rakic et coll en 2016 (16).
De même, il a été rapporté que les profils microbiens de la mucosite étaient intermédiaires entre ceux des sites implantaires sains et ceux des sites atteints de péri-implantite (2). Les pathogènes parodontaux présents au moment de la mise en place des implants joueraient un rôle dans la formation du biofilm et l’initiation de la maladie péri-implantaire, selon Daubert et Weinstein en 2019 (2). Ephros et coll en 2020 (17) ont souligné que cette transition serait marquée par l'émergence de certaines espèces connues par leur pouvoir pathogénique telles que Porphyromonas gingivalis et Aggregatibacter actinomycetemcomitans.
Une mucosite péri-implantaire présenterait alors un grand risque de constituer un précurseur pour le développement d’une péri-implantite selon le consensus de Heitz-Mayfield et coll en 2018 (18).
- • Comparaison entre une péri-implantite et une parodontite
Pour Carinci et coll en 2019 (19), la péri-implantite est généralement associée à des bactéries gram-négatif similaires à celles de la maladie parodontale. Il a été rapporté ainsi, que les antécédents de parodontite seraient liés à la survenue de l'infection péri-implantaire (19).
Bien que la mucosite soit assimilée à la gingivite et la péri-implantite à la parodontite, elles semblent être des entités cliniques distinctes. Renvert et Polyzois en 2018 (20) rapportent que l’infiltrat inflammatoire autour des implants s’étend plus en profondeur jusqu’à los alvéolaire, et même jusqu’aux espaces médullaires. Celui-ci ne serait pas encapsulé par les fibres de collagène comme on le constate autour des dents (Fig.1).
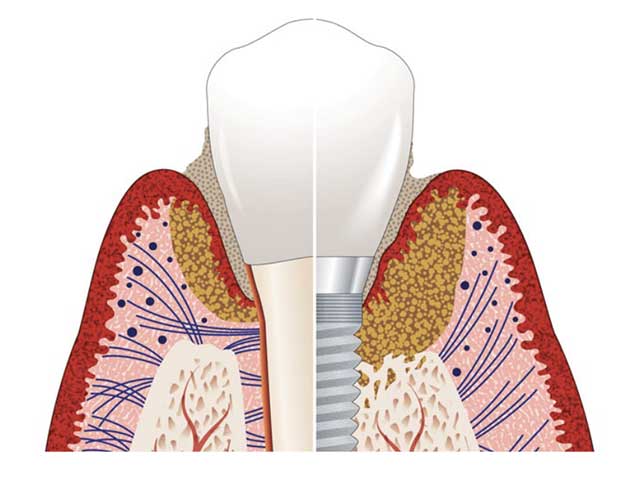
Fig.1 : Schéma comparatif illustrant l’infiltrat inflammatoire autour des dents et des implants (20).
Ceci pourrait laisser penser que les péri-implantites constituent un type d’inflammation plus aiguë (20), et un modèle de destruction plus agressif que la parodontite selon Atieh et coll 2019 (21).
2- Type d’édentement des arcades
La revue systématique de Waal et coll en 2013 (22), a rapporté des controverses quant à l’incidence des péri-implantites liée au type d’édentement.
Néanmoins, plusieurs études ont souligné que les poches parodontales autour des dents restantes sur l’arcade peuvent agir comme réservoir aux bactéries pathogènes et être responsables de la contamination des sites implantaires (23,24).
Ainsi, selon Robitaille et coll en 2016 (25) la concentration et la translocation des bactéries pathogènes vers les sites implantaires prédominent d’avantage chez l’édenté partiel que chez l’édenté total.
A ce titre Giovannoli et coll en 2019 (26) indiquent que les pathogènes parodontaux resteraient dans la cavité buccale jusqu'à 1an après une édentation complète. Ceci serait surtout retrouvé chez les sujets avec un antécédent de parodontite (26).
Daubert et Weinstein en 2019 (2) ont montré que le biofilm microbien se forme et se dépose rapidement dans un délais de 30 minutes autour des implants après leur mise en place. En absence de contrôle adéquat précoce et continu du biofilm, celui-ci peut être à l’origine de l’initiation et de l’installation d’une péri-implantite (2).
3- L’antécédent de parodontite
Les méta-analyses de Ramanauskaite et coll en 2014 (27) et de celle de Stacchi et coll en 2016 (28), prouvent que les patients atteints ou anciennement atteints de parodontites présentaient plus de complications une fois implantés. Le risque d’avoir une péri-implantite varierait selon les études et peut aller de 2,5 fois (Arunyanak et coll en 2019 (4)) à 9 fois (Kumar en 2019 (29)) chez des patients ayant des antécédents de parodontites chroniques.
De même, l’étude de Monje et coll en 2014 (30) et celle de Sousa et coll en 2016 (31) montrent que les sujets traités pour parodontites agressives auraient une incidence plus élevée de perte osseuse, de survenue de péri-implantites et d’échec implantaire.
Ainsi les auteurs s’accordent à dire que l’antécédent de parodontite constitue un facteur de risque non négligeable des péri-implantites (2,32).
4- La présence de muqueuse kératinisée
Il a été souvent considéré qu'une largeur adéquate de muqueuse kératinisée contribuait à améliorer le succès des implants. La revue systématique de Pranskunas et coll en 2016 (33) a évoqué en effet, que les sites implantaires avec une largeur < 2 mm de muqueuse kératinisée seraient plus susceptibles au développement d’une péri-implantite. Toutefois, d’après Hämmerle et coll en 2018 (34), l’absence de muqueuse kératinisée autour des implants n’augmenterait pas le risque à long terme de péri-implantites. Sa création ou son augmentation par greffe pour maintenir la santé péri-implantaire ne serait pas justifiée selon le World Workshop de 2018 (18,35).
Même si la littérature publiée sur l'importance du tissu kératinisé dans le maintien de la santé péri-implantaire n'est pas concluante, plusieurs preuves cliniques sont en faveurs de sa présence. Toutefois, Isler et coll en 2019 (36) ont montré que l'absence de muqueuse kératinisée ou la présence d’un phénotype fin rendrait un site plus sensible à la péri-implantite.
Berglundh et coll en 2018 (5), trouvent d’avantage de confort et de facilité de contrôle de plaque par le patient quand les sites implantaires disposent d’une largeur adéquate.
D’autres auteurs, tels que Monje et coll en 2019 (37), trouvent qu’une muqueuse mobile est associée à plus de récession péri-implantaire, à plus d'accumulation de plaque et donc à une plus grande prédisposition au développement d’une péri-implantite. Avila‐Ortiz et coll en 2020 (38) à leurs tour, soulignent qu’une largeur "adéquate" ≥ 2 mm de muqueuse kératinisée contribuerait davantage à réduire l’inflammation péri-implantaire.
5- L’excès de ciment de scellement :
Plusieurs travaux suggèrent que l'excès de ciment de scellement en situation sous-muqueuse constitue un facteur de risque potentiel de péri-implantite (7,37). Ceci a été également rapporté dans le consensus du groupe de travail sur les indicateurs de risques locaux par Giovannoli et coll en 2019 (26).
En effet, cet excès de ciment va se comporter comme étant un corps étranger selon Wilson en 2009 (39). Il se présentera également comme une surface rugueuse, qui favorisera la rétention des micro-organismes induisant alors la formation de biofilm selon Zandim et coll en 2019 (40).
Serino et Hultin en 2019 (41) conseillent ainsi, d’accorder une attention particulière à l’élimination complète des résidus cimentaires après scellement des supra structures prothétiques. Quant à Quaranta et coll en 2017 (42), ils recommandent dans leur étude systématique, l'utilisation du ciment d'oxyde de zinc eugénol chez les patients ayant des antécédents de parodontite.
6- Surcharge occlusale:
Dixon et London en 2019 (43) rapportent qu’une simple charge occlusale entraînerait une ouverture supplémentaire de l’interface implant-pilier, augmentant ainsi l'infiltration bactérienne.
Sur un modèle animal, il a été démontré que la surcharge occlusale accélérerait la perte osseuse péri-implantaire en présence d'inflammation d’après Kozlovsky et coll en 2007 (44). Par contre, selon Heitz-Mayfield et coll en 2004 (45), cette perte osseuse n’aurait pas eu lieu dans un environnement péri-implantaire sain.
Plusieurs signes cliniques de surcharge occlusale, ont été observés au niveau des sites atteints de péri-implantite, selon Zandim et coll en 2019 (40).
Toutefois, selon la revue systématique de Bertolini et coll en 2019 (46), la surcharge occlusale seule ne représenterait pas un facteur de risque réel de péri-implantite.
7- Les facteurs iatrogènes
Selon le consensus de 2011, certains facteurs iatrogènes seraient en effet, susceptibles d’influencer l'apparition et la progression de la péri implantite, puisqu’ils offrent un environnement idéal pour la colonisation microbienne (7).
Dans ce sens, certaines caractéristiques spécifiques seraient responsables de la création de ce microenvironnement unique autour de l’implant, qui permettrait la sélection d’une population microbienne anaérobie différente de celle de la dent naturelle selon Robitaille et coll en 2016 (25).
De même selon le consensus de World Workshop de 2018, de solides preuves montrent que le risque de péri-implantites est accru chez les patients qui ont des sites non accessibles à l'hygiène buccale (7,18). Cette prévalence de péri-implantite peut aller jusqu'à 48% selon Dixon et London en 2019 (43).
À ce titre, une mauvaise mise en place 3D de l’implant avec une épaisseur d’os ≤1,5 mm en vestibulaire et <3 mm entre 2 implants serait susceptible d’accélérer le processus de péri-implantite (Monje et coll en 2019 (37), Fu et Wang en 2015 (47)).
Aussi, une insertion incomplète du pilier ou son instabilité mécanique serait parmi les facteurs responsables du développement d’une inflammation chronique autour de la fixture de part l’infiltration microbienne qui survient au niveau de l'interface implant-pilier prothétique (Smith et coll en 2017 (48), Rosa et coll en 2019 (49)).
Un profil d’émergence défavorable avec plus de surplomb obstruerait le sulcus (Dixon et London en 2019 (43)). Des surcontours proximaux non adéquats (YI et coll en 2020 (50)) ou encore des restaurations ayant des profils concaves retenant l’excès de ciment (51) faciliteraient également la rétention de plaque et rendraient l’élimination des micro-organismes difficile (40).
Ainsi, selon Jepsen et coll en 2015 (52) toute conception prothétique ne respectant pas les contours naturels des dents, empêcherait une élimination optimale du biofilm.
Il est toujours souhaitable de privilégier des limites prothétiques en situation supra-muqueuses, particulièrement dans les secteurs postérieurs non concernés par l’esthétique d’après Serino et Hultin en 2019 (41).
Selon Kordbacheh et coll en 2019 (10) et Giovannoli et coll en 2019 (26), la présence de prothèses monoblocs ainsi que les restaurations mal ajustées seraient parmi les situations les plus incriminées.
Enfin, la position de l'implant et la conception prothétique influenceraient l'accès aux soins personnels et professionnels (7). Cependant, le rôle d’autres facteurs locaux dans le développement des maladies péri-implantaires tels que l’état de surface (53), la présence de particules de titane (7), le type de connexion implantaire (26) n’est pas à négliger.
Les facteurs de risque généraux :
1- Le tabagisme
Il en ressort des méta-analyses que le tabagisme augmenterait significativement la perte osseuse péri implantaire, affecterait négativement la cicatrisation ainsi que le pronostic (54,55,56). A ces phénomènes, s’ajouteraient une augmentation du taux de germes bactériens (57), ainsi qu’une abondance des molécules inflammatoires chez les fumeurs (58).
La péri-implantite serait 4 fois plus élevée chez les fumeurs selon Meyle et coll en 2019 (13). Pourtant le tabagisme aurait un moindre impact comparé à l'antécédent de parodontite (7). Le tabac resterait comme co-facteur controversé selon Stacchi et coll en 2016 (28). Il serait conditionné en effet par le statut du fumeur basé notamment sur sa déclaration (7,53).
Jusqu’à présent, on peut dire qu’il y a une absence de preuves concluant que fumer constitue un vrai risque pour la péri-implantite (7,21).
2- Les maladies systémiques
Certaines conditions systémiques particulières peuvent influer de façon direct ou indirect sur le pronostic de la thérapeutique implantaire (59).
Toutefois, peu de preuves scientifiques ont été rapportées sur la relation entre le développement des péri-implantites et les états systémiques en dehors (7,13,60,61,62) :
- des maladies cardiovasculaires ;
- des perturbations métaboliques ;
- de certaines pathologies osseuses et articulaires ;
- de quelques thérapeutiques ou conditions médicales (radiothérapie, chimiothérapie, bisphosphonates …).
En effet, la méta-analyse de Monje et coll en 2016 (63) et celle de Meza Maurício et coll en 2019 (64) s’accordent à dire qu’une hyperglycémie serait corrélée au développement de la péri-implantite.
Toutefois, la littérature ne permet pas de considérer le diabète comme un facteur de risque de péri-implantite. Aussi, les données suggérant les autres affections systémiques comme facteur de risque restent limitées, d’après Schwarz et coll en 2018 (7).
3- La génétique
La littérature se rapportant à l’influence des polymorphismes génétiques sur la pathogenèse des péri-implantites n’est pas concluante (65,66). Les données actuelles ne permettent donc pas de soutenir la part des prédispositions génétiques dans le risque de survenue des péri-implantites, comme il a été établit pour les parodontopathies (13).
4- La maintenance professionnelle
Des auteurs comme Roccuzzo et coll en 2018 (67) et Renvert et coll en 2019 (68) se sont intéressés à cette question. Un traitement péri-implantaire de soutien régulier serait une stratégie préventive importante contre la conversion des sites sains en mucosite péri-implantaire, et de la mucosite vers la péri-implantite (18).
Bien qu'il soit adapté au profil de risque de chaque patient, un intervalle minimum de traitement d'entretien péri-implantaire de 3 mois (69) ou de 5- 6 mois reste de règle selon Monje et coll en 2016 (70). Ceci réduirait de 25% l'incidence de la péri-implantite.
Les résultats de la thérapeutique implantaire chez les patients soumis à un programme d'entretien sont ainsi nettement améliorés à long terme selon Renvert et Quirynen en 2015 (59).
En résumé, Lin et coll en 2019 (71), attestent que toute forme de maintenance permettrait l'augmentation de la survie implantaire et la prévention de la péri-implantite.
5- L’assiduité du patient aux rendez-vous de contrôle
Les études ont démontré que la combinaison de plusieurs facteurs de risque en plus du manque d’assiduité du patient aux rendez-vous de contrôle constituerait un risque plus élevé de survenue de péri-implantite (72,73). Cette irrégularité aux rendez-vous de maintenance toucherait 1 patient sur 5 selon Rokn en 2017 (74).
D’ailleurs, la prévalence de la péri-implantite a doublé chez les patients qui n'ont eu aucune visite de maintenance dans les 5 premières années suivant le traitement implantaire par rapport à ceux qui étaient vus au moins une fois par an selon Costa et coll en 2012 (75).
D’après Zeza et coll en 2017 (76), les patients les plus motivés seraient les sujets parodonto-conscients. Les indices comportementaux d’hygiène seraient ainsi, corrélés à l’assiduité du patient et constitueraient de vrais indicateurs des péri-implantites (77).
Il existe de fortes preuves que l’insuffisance du contrôle de plaque associée à l’irrégularité du traitement de soutien constituent des facteurs de risque des péri-implantites (7).
RECOMMANDATIONS POUR LA PREVENTION DES PERI-IMPLANTITES
Dans le cadre du World Workshop, Jepsen et coll en 2015 (52), ont proposé des recommandations concernant la prévention de la péri-implantite.
Idéalement, le praticien se doit :
- d’informer les patients sur les complications comme les maladies péri-implantaires et la nécessité de soins préventifs,
- d’effectuer une évaluation individuelle du risque systémique et local,
- d’instaurer une hygiène orale et de mettre en place une prise en charge des parodontites et du sevrage tabagique,
- de programmer une maintenance personnalisée adaptée au profil de chaque patient .
CONCLUSION
Le biofilm bactérien constitue le principal facteur étiologique des péri-implantites. Pour prévenir la survenue d’une péri-implantite, il est recommandé de suivre une démarche thérapeutique rigoureuse dès l’élaboration du projet implantaire. Le praticien a donc pour mission d’adapter sa prise en charge suivant le profil à risque du patient.
BIBLIOGRAPHIE
1. Stokman MA, van Winkelhoff AJ, Vissink A, Spijkervet FKL, Raghoebar GM. Bacterial colonization of the peri-implant sulcus in dentate patients: a prospective observational study. Clin Oral Investig. 2017 Mar;21(2):717–24.
2. Daubert DM, Weinstein BF. Biofilm as a risk factor in implant treatment. Periodontol 2000. 2019 Oct;81(1):29–40.
3. Renvert S, Persson GR, Pirih FQ, Camargo PM. Peri-implant health, peri-implant mucositis, and peri-implantitis: Case definitions and diagnostic considerations: Diagnostic criteria of peri-implant health and diseases. J Clin Periodontol. 2018 Jun;45:S278–85.
4. Arunyanak SP, Sophon N, Tangsathian T, Supanimitkul K, Suwanwichit T, Kungsadalpipob K. The effect of factors related to periodontal status toward peri‐implantitis. Clin Oral Implants Res. 2019 Aug;30(8):791–9.
5. Berglundh T, Armitage G, Araujo MG, Avila-Ortiz G, Blanco J, Camargo PM, et al. Peri-implant diseases and conditions: Consensus report of workgroup 4 of the 2017 World Workshop on the Classification of Periodontal and Peri-Implant Diseases and Conditions. J Clin Periodontol. 2018 Jun;45:S286–91.
6. Derks J, Tomasi C. Peri-implant health and disease. A systematic review of current epidemiology. J Clin Periodontol. 2015 Apr;42:S158–71.
7. Schwarz F, Derks J, Monje A, Wang H-L. Peri-implantitis. J Clin Periodontol. 2018 Jun;45:S246–66.
8. Zitzmann NU, Berglundh T. Definition and prevalence of peri-implant diseases. J Clin Periodontol. 2008 Sep;35:286–91.
9. Lee C-T, Huang Y-W, Zhu L, Weltman R. Prevalences of peri-implantitis and peri-implant mucositis: systematic review and meta-analysis. J Dent. 2017 Jul;62:1–12.
10. Kordbacheh Changi K, Finkelstein J, Papapanou PN. Peri‐implantitis prevalence, incidence rate, and risk factors: A study of electronic health records at a U.S. dental school. Clin Oral Implants Res. 2019 Apr;30(4):306–14.
11. Kissa J, El Kholti W, Chemlali S, Kawtari H, Laalou Y, Albandar JM. Prevalence and risk indicators of peri‐implant diseases in a group of Moroccan patients. J Periodontol. 2020 Dec 29;JPER.20-0549.
12. Insua A, Monje A, Wang H-L, Inglehart M. Patient-Centered Perspectives and Understanding of Peri-Implantitis. J Periodontol. 2017 Nov;88(11):1153–62.
13. Meyle J, Casado P, Fourmousis I, Kumar P, Quirynen M, Salvi GE. General genetic and acquired risk factors, and prevalence of peri‐implant diseases – Consensus report of working group 1. Int Dent J. 2019 Sep;69(S2):3–6.
14. Akram Z, Al‐Aali KA, Alrabiah M, Alonaizan FA, Abduljabbar T, AlAhmari F, et al. Current weight of evidence of viruses associated with peri‐implantitis and peri‐implant health: A systematic review and meta‐analysis. Rev Med Virol. 2019 May;29(3):e2042.
15. Mombelli A, Décaillet F. The characteristics of biofilms in peri-implant disease: Biofilms in peri-implant disease. J Clin Periodontol. 2011 Mar;38:203–13.
16. Rakic M, Grusovin M, Canullo L. The Microbiologic Profile Associated with Peri-Implantitis in Humans: A Systematic Review. Int J Oral Maxillofac Implants. 2016 Mar;31(2):359–68.
17. Ephros H, Kim S, DeFalco R. Peri-implantitis. Dent Clin North Am. 2020 Apr;64(2):305–13.
18. Heitz-Mayfield LJA, Salvi GE. Peri-implant mucositis. J Clin Periodontol. 2018 Jun;45:S237–45.
19. Carinci D, Lauritano D, Bignozzi CA, Pazzi D, Candotto V, Santos de Oliveira P, et al. A New Strategy Against Peri-Implantitis: Antibacterial Internal Coating. Int J Mol Sci. 2019 Aug 9;20(16):3897.
20. Renvert S, Polyzois I. Treatment of pathologic peri-implant pockets. Periodontol 2000. 2018;Feb; 76(1):180–90.
21. Atieh MA, Pang JK, Lian K, Wong S, Tawse‐Smith A, Ma S, et al. Predicting peri‐implant disease: Chi‐square automatic interaction detection (CHAID) decision tree analysis of risk indicators. J Periodontol. 2019 Aug;90(8):834–46.
22. de Waal YCM, van Winkelhoff AJ, Meijer HJA, Raghoebar GM, Winkel EG. Differences in peri-implant conditions between fully and partially edentulous subjects: a systematic review. J Clin Periodontol. 2013 Mar;40(3):266–86.
23. Charalampakis G, Belibasakis GN. Microbiome of peri-implant infections: Lessons from conventional, molecular and metagenomic analyses. Virulence. 2015 Apr 3;6(3):183–7.
24. Belibasakis GN, Charalampakis G, Bostanci N, Stadlinger B. Peri-Implant Infections of Oral Biofilm Etiology. In: Donelli G, editor. Biofilm-based Healthcare-associated Infections [Internet]. Springer International Publishing; 2015 [cited 2018 Mar 15]. p. 69–84. (Peri-implant infections of or Advances in Experimental Medicine and Biology; vol. 830). Available from: https://doi.org/10.5167/uzh-102760
25. Robitaille N, Reed DN, Walters JD, Kumar PS. Periodontal and peri-implant diseases: identical or fraternal infections? Mol Oral Microbiol. 2016 Aug;31(4):285–301.
26. Giovannoli J, Roccuzzo M, Albouy J, Duffau F, Lin G, Serino G. Local risk indicators – Consensus report of working group 2. Int Dent J. 2019 Sep;69(S2):7–11.
27. Ramanauskaite A, Baseviciene N, Wang H-L, Tözüm TF. Effect of History of Periodontitis on Implant Success: Meta-Analysis and Systematic Review. Implant Dent. 2014;23(6):687–96.
28. Stacchi C, Berton F, Perinetti G, Frassetto A, Lombardi T, Khoury A, et al. Risk Factors for Peri-Implantitis: Effect of History of Periodontal Disease and Smoking Habits. A Systematic Review and Meta-Analysis. J Oral Maxillofac Res. 2016 Sep 9;7(3):e3.
29. Kumar PS. Systemic Risk Factors for the Development of Periimplant Diseases: Implant Dent. 2019 Apr;28(2):115–9.
30. Monje A, Alcoforado G, Padial-Molina M, Suarez F, Lin G-H, Wang H-L. Generalized Aggressive Periodontitis as a Risk Factor for Dental Implant Failure: A Systematic Review and Meta-Analysis. J Periodontol. 2014 Oct;85(10):1398–407.
31. Sousa V, Mardas N, Farias B, Petrie A, Needleman I, Spratt D, et al. A systematic review of implant outcomes in treated periodontitis patients. Clin Oral Implants Res. 2016 Jul;27(7):787–844.
32. Cosgarea R, Sculean A, Shibli JA, Salvi GE. Prevalence of peri-implant diseases – a critical review on the current evidence. Braz Oral Res. 2019 Sep 30;33(suppl 1):e063.
33. Pranskunas M, Poskevicius L, Juodzbalys G, Kubilius R, Jimbo R. Influence of Peri-Implant Soft Tissue Condition and Plaque Accumulation on Peri-Implantitis: a Systematic Review. J Oral Maxillofac Res. 2016 Sep 9;7(3):e2.
34. Hämmerle CHF, Tarnow D. The etiology of hard- and soft-tissue deficiencies at dental implants: A narrative review. J Clin Periodontol. 2018 Jun;45:S267–77.
35. Araujo MG, Lindhe J. Peri-implant health. J Clin Periodontol. 2018 Jun;45:S230–6.
36. Isler S, Uraz A, Kaymaz O, Cetiner D. An Evaluation of the Relationship Between Peri-implant Soft Tissue Biotype and the Severity of Peri-implantitis: A Cross-Sectional Study. Int J Oral Maxillofac Implants. 2019 Jan;34(1):187–96.
37. Monje A, Insua A, Wang H-L. Understanding Peri-Implantitis as a Plaque-Associated and Site-Specific Entity: On the Local Predisposing Factors. J Clin Med. 2019 Feb 25;8(2):279.
38. Avila‐Ortiz G, Gonzalez‐Martin O, Couso‐Queiruga E, Wang H. The peri‐implant phenotype. J Periodontol. 2020 Mar;91(3):283–8.
39. Wilson Jr. TG. The Positive Relationship Between Excess Cement and Peri-Implant Disease: A Prospective Clinical Endoscopic Study. J Periodontol. 2009 Sep;80(9):1388–92.
40. Zandim-Barcelos DL, Carvalho GG de, Sapata VM, Villar CC, Hämmerle C, Romito GA. Implant-based factor as possible risk for peri-implantitis. Braz Oral Res. 2019;33(suppl 1):e067.
41. Serino G, Hultin K. Periimplant Disease and Prosthetic Risk Indicators: A Literature Review. Implant Dent. 2019 Apr;28(2):125–37.
42. Quaranta A, Lim ZW, Tang J, Perrotti V, Leichter J. The Impact of Residual Subgingival Cement on Biological Complications Around Dental Implants: A Systematic Review. Implant Dent. 2017 Jun;26(3):465–74.
43. Dixon DR, London RM. Restorative design and associated risks for peri‐implant diseases. Periodontol 2000. 2019 Oct;81(1):167–78.
44. Kozlovsky A, Tal H, Laufer B-Z, Leshem R, Rohrer MD, Weinreb M, et al. Impact of implant overloading on the peri-implant bone in inflamed and non-inflamed peri-implant mucosa. Clin Oral Implants Res. 2007 Oct;18(5):601–10.
45. Heitz-Mayfield LJ, Schmid B, Weigel C, Gerber S, Bosshardt DD, Jonsson J, et al. Does excessive occlusal load affect osseointegration? An experimental study in the dog. Clin Oral Implants Res. 2004 Jun;15(3):259–68.
46. Bertolini MM, Del Bel Cury AA, Pizzoloto L, Acapa IRH, Shibli JA, Bordin D. Does traumatic occlusal forces lead to peri-implant bone loss? A systematic review. Braz Oral Res. 2019;33(suppl 1):e069.
47. Fu JH, Wang HL. Can Periimplantitis Be Treated? Dent Clin North Am. 2015 Oct;59(4):951–80.
48. Smith MM, Knight ET, Al-Harthi L, Leichter JW. Chronic periodontitis and implant dentistry. Periodontol 2000. 2017;74(1):63–73.
49. Rosa EC, Deliberador TM, Nascimento TCLD, Kintopp CCA, Orsi JSR, Wambier LM, et al. Does the implant-abutment interface interfere on marginal bone loss? A systematic review and meta-analysis. Braz Oral Res. 2019;33(suppl 1):e068.
50. Yi Y, Koo K, Schwarz F, Ben Amara H, Heo S. Association of prosthetic features and peri‐implantitis: A cross‐sectional study. J Clin Periodontol. 2020 Mar;47(3):392–403.
51. Sancho-Puchades M, Crameri D, Özcan M, Sailer I, Jung RE, Hämmerle CHF, et al. The influence of the emergence profile on the amount of undetected cement excess after delivery of cement-retained implant reconstructions. Clin Oral Implants Res. 2017 Dec;28(12):1515–22.
52. Jepsen S, Berglundh T, Genco R, Aass AM, Demirel K, Derks J, et al. Primary prevention of peri-implantitis: Managing peri-implant mucositis. J Clin Periodontol. 2015 Apr;42(Suppl 16):S152–7.
53. Fu J, Wang H. Breaking the wave of peri‐implantitis. Periodontol 2000. 2020 Oct;84(1):145–60.
54. Clementini M, Rossetti PHO, Penarrocha D, Micarelli C, Bonachela WC, Canullo L. Systemic risk factors for peri-implant bone loss: a systematic review and meta-analysis. Int J Oral Maxillofac Surg. 2014 Mar;43(3):323–34.
55. Chrcanovic BR, Albrektsson T, Wennerberg A. Smoking and dental implants: A systematic review and meta-analysis. J Dent. 2015 May;43(5):487–98.
56. Sgolastra F, Petrucci A, Severino M, Gatto R, Monaco A. Smoking and the risk of peri-implantitis. A systematic review and meta-analysis. Clin Oral Implants Res. 2015 Apr;26(4):e62–7.
57. Lafaurie GI, Sabogal MA, Castillo DM, Rincón MV, Gómez LA, Lesmes YA, et al. Microbiome and Microbial Biofilm Profiles of Peri-Implantitis: A Systematic Review. J Periodontol. 2017 Oct;88(10):1066–89.
58. ArRejaie AS, Al‐Aali KA, Alrabiah M, Vohra F, Mokeem SA, Basunbul G, et al. Proinflammatory cytokine levels and peri‐implant parameters among cigarette smokers, individuals vaping electronic cigarettes, and non‐smokers. J Periodontol. 2019 Apr;90(4):367–74.
59. Renvert S, Quirynen M. Risk indicators for peri-implantitis. A narrative review. Clin Oral Implants Res. 2015 Sep;26(Suppl 11):15–44.
60. Gurgel BC de V, Montenegro SCL, Dantas PMC, Pascoal ALB, Lima KC, Calderon PDS. Frequency of peri-implant diseases and associated factors. Clin Oral Implants Res. 2017 Oct;28(10):1211–7.
61. Turri A, Rossetti P, Canullo L, Grusovin M, Dahlin C. Prevalence of Peri-implantitis in Medically Compromised Patients and Smokers: A Systematic Review. Int J Oral Maxillofac Implants. 2016 Jan;31(1):111–8.
62. Guobis Z, Pacauskiene I, Astramskaite I. General Diseases Influence on Peri-Implantitis Development: a Systematic Review. J Oral Maxillofac Res. 2016 Sep 9;7(3):e5.
63. Monje A, Catena A, Borgnakke WS. Association between diabetes mellitus/hyperglycaemia and peri-implant diseases: Systematic review and meta-analysis. J Clin Periodontol. 2017 Jun;44(6):636–48.
64. Meza Maurício J, Miranda TS, Almeida ML, Silva HD, Figueiredo LC, Duarte PM. An umbrella review on the effects of diabetes on implant failure and peri-implant diseases. Braz Oral Res. 2019 Sep 30;33(suppl 1):e070.
65. Fourmousis I, Vlachos M. Genetic Risk Factors for the Development of Periimplantitis: Implant Dent. 2019 Apr;28(2):103–14.
66. Chen X, Zhao Y. Genetic Involvement in Dental Implant Failure: Association With Polymorphisms of Genes Modulating Inflammatory Responses and Bone Metabolism. J Oral Implantol. 2019 Aug 1;45(4):318–26.
67. Roccuzzo M, Layton DM, Roccuzzo A, Heitz‐Mayfield LJ. Clinical outcomes of peri‐implantitis treatment and supportive care: A systematic review. Clin Oral Implants Res. 2018 Oct;29(S16):331–50.
68. Renvert S, Hirooka H, Polyzois I, Kelekis‐Cholakis A, Wang H, Working Group 3. Diagnosis and non‐surgical treatment of peri‐implant diseases and maintenance care of patients with dental implants – Consensus report of working group 3. Int Dent J. 2019 Sep;69(Suppl 2):12–7.
69. Frisch E, Ziebolz D, Vach K, Ratka P. Supportive post‐implant therapy: patient compliance rates and impacting factors: 3‐year follow‐up. 2014;8.
70. Monje A, Aranda L, Diaz KT, Alarcón MA, Bagramian RA, Wang HL, et al. Impact of maintenance therapy for the prevention of peri-implant diseases: a systematic review and meta-analysis. J Dent Res. 2016;95(4):372–9.
71. Lin C, Chen Z, Pan W, Wang H. The effect of supportive care in preventing peri‐implant diseases and implant loss: A systematic review and meta‐analysis. Clin Oral Implants Res. 2019 Aug;30(8):714–24.
72. Monje A, Wang H-L, Nart J. Association of Preventive Maintenance Therapy Compliance and Peri-Implant Diseases: A Cross-Sectional Study. J Periodontol. 2017 Oct;88(10):1030–41.
73. Cortellini S, Favril C, De Nutte M, Teughels W, Quirynen M. Patient compliance as a risk factor for the outcome of implant treatment. Romanos GE, editor. Periodontol 2000. 2019 Oct;81(1):209–25.
74. Rokn A, Aslroosta H, Akbari S, Najafi H, Zayeri F, Hashemi K. Prevalence of peri-implantitis in patients not participating in well-designed supportive periodontal treatments: a cross-sectional study. Clin Oral Implants Res. 2017 Mar;28(3):314–9.
75. Costa FO, Takenaka-Martinez S, Cota LOM, Ferreira SD, Silva GLM, Costa JE. Peri-implant disease in subjects with and without preventive maintenance: a 5-year follow-up. J Clin Periodontol. 2012 Feb;39(2):173–81.
76. Zeza B, Pilloni A, Tatakis DN, Mariotti A, Di Tanna GL, Mongardini C. Implant Patient Compliance Varies by Periodontal Treatment History. J Periodontol. 2017 Sep;88(9):846–53.
77. Tecco S, Grusovin M, Sciara S, Bova F, Pantaleo G, Capparé P. The association between three attitude-related indexes of oral hygiene and secondary implant failures: A retrospective longitudinal study. Int J Dent Hyg. 2017 Aug;16(3):372–9.








