Y. GUERROUDJ*, M. THEOLOGITI*, J. ZIGOVIC*, C. NICAISE **, A. SHAYEGAN*
* Département dentisterie pédiatrique,
Université Libre de Bruxelles, Belgique
** Département d’hystologie,
** Département d’hystologie,
Université de Namur, Belgique
RÉSUMÉ
L’ingénierie tissulaire est la science de la conception et la fabrication de nouveaux tissus pour remplacer les facultés affaiblies ou endommagées. Les ingrédients essentiels pour l'ingénierie tissulaire sont : les cellules souches, les morphogènes ou des facteurs de croissance et un échafaudage de la matrice extracellulaire.
La thérapie régénérative offre une alternative intéressante aux approches réparatrices plus traditionnelles en remplaçant le tissu affecté par un tissu qui fait partie intégrante de la dent.
Par leur facilité d’accès et un haut potentiel de prolifération, les cellules souches d’origine dentaire se révèle être d’un intérêt scientifique grandissant.
La découverte de ces cellules souches, les avancées des recherches sur leur isolement, leur caractérisation et leur potentiel de différenciation permettrait d’envisager des stratégies thérapeutiques afin d’amplifier le phénomène naturel de réparation de l’organisme.
Cependant, une meilleure connaissance du fonctionnement de ces cellules est nécessaire pour une maîtrise de la multiplication cellulaire et la création d’un protocole applicable, car au-delà de la thérapeutique visant à régénérer les tissus dentaires, les cellules souches pulpaires peuvent également se différentier en cellules adipeuses, cartilagineuses et même neuronales
Mot clés : Cellules souches mésenchymateuse ; DPSC ; SHED ; isolation ; mise en culture ; phénotype et caractérisation des cellules souches pulpaires ; régénération pulpaire ; ingénierie tissulaire.
Par leur facilité d’accès et un haut potentiel de prolifération, les cellules souches d’origine dentaire se révèle être d’un intérêt scientifique grandissant.
La découverte de ces cellules souches, les avancées des recherches sur leur isolement, leur caractérisation et leur potentiel de différenciation permettrait d’envisager des stratégies thérapeutiques afin d’amplifier le phénomène naturel de réparation de l’organisme.
Cependant, une meilleure connaissance du fonctionnement de ces cellules est nécessaire pour une maîtrise de la multiplication cellulaire et la création d’un protocole applicable, car au-delà de la thérapeutique visant à régénérer les tissus dentaires, les cellules souches pulpaires peuvent également se différentier en cellules adipeuses, cartilagineuses et même neuronales
Mot clés : Cellules souches mésenchymateuse ; DPSC ; SHED ; isolation ; mise en culture ; phénotype et caractérisation des cellules souches pulpaires ; régénération pulpaire ; ingénierie tissulaire.
INTRODUCTION
Le terme de « cellule souche » désigne une cellule indifférenciée, capable de s’auto-renouveler et de se différencier en cellules spécialisées. Il existe principalement deux catégories de cellules souches : les cellules souches embryonnaires (ES) et les cellules souches adultes (SCA) (1,2).
L’oeuf fécondé (le zygote) et les cellules issues de ses premières divisions (les blastomères) peuvent conduire à la constitution d’un organisme entier. Ces cellules sont dites « totipotentes ». Puis, l’embryon s’organise en territoires spécialisés, ayant chacun un destin propre. Ses cellules conservent un potentiel de différenciation et peuvent former tous les tissus de l’organisme, elles sont dites « pluripotentes » (1).
Les cellules souches adultes sont, pour leur part, déjà engagées dans un programme tissulaire spécifique et sont capables de se différencier et former des cellules d’un nombre limité de tissus. Elles sont dites « multipotentes » et servent au maintien du tissu sain et à la réparation du tissu endommagé, d’origine ou non (1,2).
Les cellules ES présentent un avantage comparées aux SCA. Cependant, leur origine embryonnaire pose des problèmes d’éthique et les chercheurs se tournent de plus en plus vers les cellules souches adultes, notamment celles d’origine mésenchymateuses (MSCs). Des cellules semblables aux MSCs ont également été isolées à partir de la peau, du tissu adipeux et au niveau du tissu dentaire (les MSCs-like).
Ainsi, les premières cellules souches dentaires ont été isolées et identifiées en 2000 par Gronthos et son équipe. Cette population de cellules souches a été appelée dental pulp stem cells (DPSC) (3).
En 2002, Miura et coll. ont mis en évidence la présence de cellules souches dans les restes pulpaires dérivés de dents déciduales exfoliées appelées stem cells from human exfoliated decicuous teeth (SHED) (4).
Cette étude a pour but d’isoler et de caractériser les cellules souches pulpaires obtenu à partir de dents lactéales (DPSCs) et de dents définitifs (SHED) ainsi que de comparer leur phénotype.
L’oeuf fécondé (le zygote) et les cellules issues de ses premières divisions (les blastomères) peuvent conduire à la constitution d’un organisme entier. Ces cellules sont dites « totipotentes ». Puis, l’embryon s’organise en territoires spécialisés, ayant chacun un destin propre. Ses cellules conservent un potentiel de différenciation et peuvent former tous les tissus de l’organisme, elles sont dites « pluripotentes » (1).
Les cellules souches adultes sont, pour leur part, déjà engagées dans un programme tissulaire spécifique et sont capables de se différencier et former des cellules d’un nombre limité de tissus. Elles sont dites « multipotentes » et servent au maintien du tissu sain et à la réparation du tissu endommagé, d’origine ou non (1,2).
Les cellules ES présentent un avantage comparées aux SCA. Cependant, leur origine embryonnaire pose des problèmes d’éthique et les chercheurs se tournent de plus en plus vers les cellules souches adultes, notamment celles d’origine mésenchymateuses (MSCs). Des cellules semblables aux MSCs ont également été isolées à partir de la peau, du tissu adipeux et au niveau du tissu dentaire (les MSCs-like).
Ainsi, les premières cellules souches dentaires ont été isolées et identifiées en 2000 par Gronthos et son équipe. Cette population de cellules souches a été appelée dental pulp stem cells (DPSC) (3).
En 2002, Miura et coll. ont mis en évidence la présence de cellules souches dans les restes pulpaires dérivés de dents déciduales exfoliées appelées stem cells from human exfoliated decicuous teeth (SHED) (4).
Cette étude a pour but d’isoler et de caractériser les cellules souches pulpaires obtenu à partir de dents lactéales (DPSCs) et de dents définitifs (SHED) ainsi que de comparer leur phénotype.
MATÉRIELS ET MÉTHODES
Quatre dents lactéales et définitives ont été extraites (62, 63, 65, 72, 38,48, 18, 28) dans un contexte orthodontique. Le consentement éclairé a été obtenu auprès des parents et des patients. Le protocole a été approuvé par le Comité d’éthique de L’hôpital Des Enfants Reine Fabiola (Université Libre de Bruxelles).
La pulpe prélevée de chaque dent a ensuite été découpée en petits morceaux et plongée dans une solution contenant du Phosphate Buffered Saline (PBS) (BE17-516F, Lonza, Belgique), de la pénicilline et de la streptomycine (3%).
Le tissu pulpaire a été digéré dans une solution contenant 3mg/ml de collagénase de type I (Sigma-Aldrich) et laissés pendant 1h, à 37°C, sous atmosphère humide, contenant 5 % de CO2.
Les cellules ont ensuite été ensemencées dans un milieu contenant une solution de alpha-MEM, 10% de FBS, 1% de Glutamax (Invitrogen) et 0,5% de Pen-Strep, dans une boîte de pétri de 100 mm de diamètre et placées 48h à 37°C, sous atmosphère humide contenant 5% de CO2. Le milieu de culture a été renouvelé tous les 2,3 jours.
A 70%-90% de confluence, les cellules ont été trypsinisé (Trypsin-EDTA à 0.25%). Le milieu de culture (alphaMEM + FBS+ Glutamax+Pénicillin) a été changé tous les 3 jours jusqu’à l’obtention de 200 000 cellules / boîte de Pétri/50 ml.
Afin de caractériser les cellules, la cytométrie en flux a été réalisée par le biais de la réaction antigène-anticorps utilisant les marqueurs CD73, CD90, CD 105, HLA-DR suivie d’une transcription inverse- réaction en chaîne par polymérase (RT-PCR) utilisant les amorces Nestin, Oct3/4, Sox 2, Nanog.
La pulpe prélevée de chaque dent a ensuite été découpée en petits morceaux et plongée dans une solution contenant du Phosphate Buffered Saline (PBS) (BE17-516F, Lonza, Belgique), de la pénicilline et de la streptomycine (3%).
Le tissu pulpaire a été digéré dans une solution contenant 3mg/ml de collagénase de type I (Sigma-Aldrich) et laissés pendant 1h, à 37°C, sous atmosphère humide, contenant 5 % de CO2.
Les cellules ont ensuite été ensemencées dans un milieu contenant une solution de alpha-MEM, 10% de FBS, 1% de Glutamax (Invitrogen) et 0,5% de Pen-Strep, dans une boîte de pétri de 100 mm de diamètre et placées 48h à 37°C, sous atmosphère humide contenant 5% de CO2. Le milieu de culture a été renouvelé tous les 2,3 jours.
A 70%-90% de confluence, les cellules ont été trypsinisé (Trypsin-EDTA à 0.25%). Le milieu de culture (alphaMEM + FBS+ Glutamax+Pénicillin) a été changé tous les 3 jours jusqu’à l’obtention de 200 000 cellules / boîte de Pétri/50 ml.
Afin de caractériser les cellules, la cytométrie en flux a été réalisée par le biais de la réaction antigène-anticorps utilisant les marqueurs CD73, CD90, CD 105, HLA-DR suivie d’une transcription inverse- réaction en chaîne par polymérase (RT-PCR) utilisant les amorces Nestin, Oct3/4, Sox 2, Nanog.
 |
RÉSULTATS
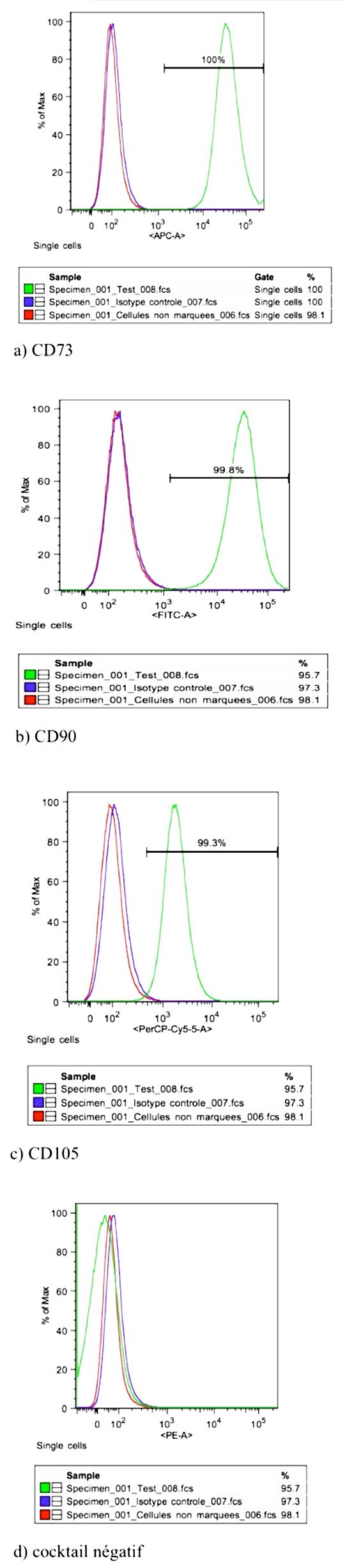
Dans la présente étude, les cellules ont exprimé à plus de 95% les marqueurs de surface CD 73, CD 90, CD 105 et à 0% les marqueurs hématopoïétiques et HLA-DR (Fig.1).
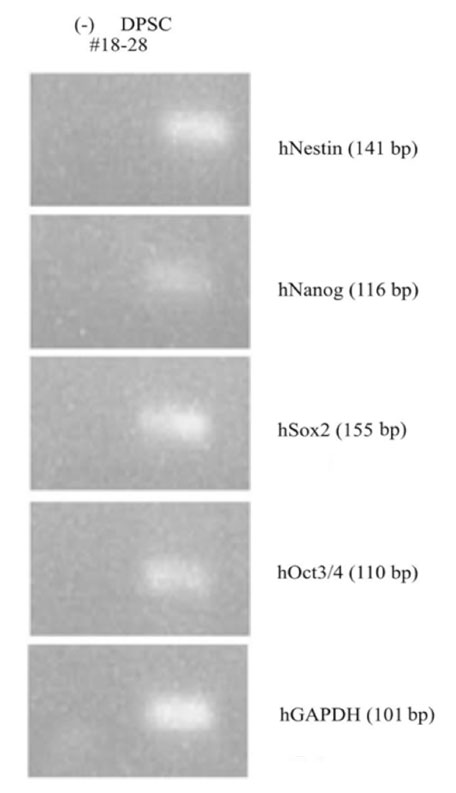
Le RT-PCR révèle l’expression de marqueurs de cellules mésenchymateuses (Nestin, OCT3/ 4, Sox2 et Nanog) (Fig.2).
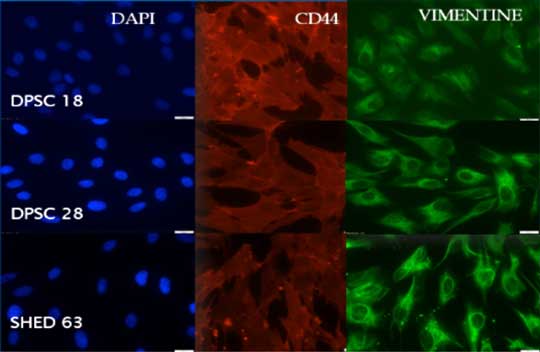
L'analyse par immunofluorescence a clairement montrée l’expression de certains marqueurs au niveau des SHEDs/ DPSCs (DAPI, CD44 et Vimentine) (Fig.3).
|
|
 |
DISCUSSION
Depuis la découverte des cellules souches pulpaires par Gronthos et coll., de nombreux chercheurs se sont lancés le défi de cultiver les cellules souches pulpaires, utilisant un protocole similaire à celui établi pour isoler et caractériser les cellules souches mésenchymateuses de la moelle osseuse (BMSCs) (5,6).
En général, l'expression de quelques marqueurs est nécessaire pour caractériser une population de cellules en tant que cellules souches mésenchymateuses (7).
Due à l’absence d’une dénomination commune et entre les différents protocoles établis pour isoler et caractériser les MSCs, l’ISCT (International Society for Cellular Therapy) a établi des critères minimums de définition (8) :
• Adhérence au plastique,
• L’expression des marqueurs de surface CD73, CD90, CD 105 et l’absence d’expression des marqueurs hématopoïétiques CD34 , CD45 , CD19 , CD11a et Human leukocyte antigen-DR (HLA-DR),
• Capacité à se différencier, in vitro, dans les types cellulaires du lignage mésenchymateux (adipocytes, ostéoblastes, chondroblastes).
Les résultats obtenus dans cette étude sont en accord avec les deux premiers critères établis par l’ISCT.
La cytométrie en flux et l’immunofluorescence ont montré des résultats similaires pour les DPSC et SHED.
Les DPSCs et les SHEDs ont pour même origine les cellules ecto-mésenchymateuse de la crête neurale et possèdent les mêmes propriétés telles que la multipotence et l’auto-renouvellement. Cependant, des études ont montrés que leurs profils d’expression génétique diffèrent.
En général, l'expression de quelques marqueurs est nécessaire pour caractériser une population de cellules en tant que cellules souches mésenchymateuses (7).
Due à l’absence d’une dénomination commune et entre les différents protocoles établis pour isoler et caractériser les MSCs, l’ISCT (International Society for Cellular Therapy) a établi des critères minimums de définition (8) :
• Adhérence au plastique,
• L’expression des marqueurs de surface CD73, CD90, CD 105 et l’absence d’expression des marqueurs hématopoïétiques CD34 , CD45 , CD19 , CD11a et Human leukocyte antigen-DR (HLA-DR),
• Capacité à se différencier, in vitro, dans les types cellulaires du lignage mésenchymateux (adipocytes, ostéoblastes, chondroblastes).
Les résultats obtenus dans cette étude sont en accord avec les deux premiers critères établis par l’ISCT.
La cytométrie en flux et l’immunofluorescence ont montré des résultats similaires pour les DPSC et SHED.
Les DPSCs et les SHEDs ont pour même origine les cellules ecto-mésenchymateuse de la crête neurale et possèdent les mêmes propriétés telles que la multipotence et l’auto-renouvellement. Cependant, des études ont montrés que leurs profils d’expression génétique diffèrent.
Les SHEDS présentent certains avantages comparés aux DPSCs (4 ,5) :
- Un accès aisé puisque les enfants perdent naturellement leurs dents de lait,
- Un plus grand potentiel de prolifération et un nombre de doublement de population cellulaire accru, plus élevée également que les BMSCs,
- Elles représentent une population de cellules souches multipotentes plus immatures et répondraient mieux à la différenciation.
Ainsi, les dents exfoliées peuvent être une ressource inattendue pour les thérapies de cellules souches, y compris une greffe autologue de cellules souches et du génie tissulaire.
UTILISATION DES CELLULES SOUCHES D’ORIGINES DENTAIRES
Les méthodes actuelles pour réparer et / ou remplacer les tissus dentaires utilisent principalement des matériaux synthétiques, dont les propriétés physiques et mécaniques sont distinctes de ceux des dents naturelles. Grâce au potentiel de différenciation des DPSCs /SHEDs en différents types cellulaires, les possibilités de leur exploitation dans la régénération des tissus dentaires et le domaine de l’ingénierie tissulaire sont de plus en plus évoquées.
Ces résultats permettent d’envisager des stratégies thérapeutiques visant par exemple à mobiliser les cellules souches résidentes de la pulpe afin d’amplifier le pouvoir naturel de réparation dentaire (9).
En effet, le phénomène de réparation dentinaire suscite la curiosité des scientifiques depuis de longues décennies. En réponse à une agression dentino-pulpaire, provoquant la dégénérescence des odontoblastes, des précurseurs pulpaires peuvent se différencier en odontoblastes de 2ème génération et former de la dentine réactionnelle. Cependant, si l’atteinte pulpaire est importante, les odontoblastes et les cellules de la couche sous-odontoblastique disparaissent et la dentine réparatrice est secrétée par les odontoblastes-like issues de la différenciation des cellules progénitrices ou cellules souches pulpaires.
Le recrutement d'une population de cellules souches, leur différenciation en une nouvelle génération de cellules odontoblastiques-like, conduisant à la dentinogenèse réparatrice, est une réponse physiologique du complexe dentino-pulpaire (3). Cependant, cette réponse physiologique, étant aléatoire et incontrôlée (10), pousse les chercheurs au recrutement dirigé des DPSCs /SHEDs.
L’induction des cellules souches dans la voie de différenciation choisie nécessite l’apport de facteurs d’induction adéquats. Le facteur de croissance le plus communément utilisé pour induire la différenciation des DPSCs en odontoblastes est la BMP2 (Bone Morphogenetic Protein 2). L’intérêt d’autres facteurs de croissances telles que TGFβ (Transforming Growth Factor), l'IGF (Insulin Growth Factor) ou la protéine BSP (Bone Sialo Protein) a également été démontré (2).
Placés au contact de la pulpe, ces facteurs provoquent le recrutement des DPSCs /SHEDs, qui se différencient et produisent une matrice minéralisée. Cette induction peut se faire de deux manières : les méthodes in vivo et ex vivo (2).
Le concept de l'ingénierie de l’organe dentaire a été montré potentiellement réalisable in vivo sur des modèles animaux (11). Le but ultime des chercheurs reste la reconstruction et l’implantation de l’organe dentaire chez l’homme.
Les études actuelles examinent également si une réparation parodontale totale peut être obtenue après une transplantation de cellules souches associées à un substitut osseux.
Lorsque les thérapeutiques conventionnelles mécaniques ou chirurgicales ne sont pas suffisantes, les techniques de régénérations cellulaires, à l’aide de dispositifs membranaires ou les amélogénines sont utilisées. Celles-ci ont pour objectifs de stimuler les cellules progénitrices ou les cellules souches présentent dans le parodonte résiduel. Cette stimulation va être dépendante de la sévérité des lésions, plus la destruction tissulaire sera avancée, plus les sources cellulaires seront diminuées (12).
Des études suggèrent que la culture des cellules souches du ligament parodontal résiduel (PDLSCs) sur un support matriciel est capable de régénérer un tissu semblable au complexe cément/ligament parodontal.
L’utilisation d’hydroxyapatite et de phosphate tricalcique comme support matriciel donne de bons résultats (13, 14).
L’utilisation de cellules souches afin de réparer les défauts osseux cranio-faciaux d’origines traumatiques, cancéreuses ou pathologiques peut être une alternative aux auto-allogreffes.
D’un point de vue plus général, l’utilisation possible des cellules souches dentaires dans le domaine médical est également étudiée.
Les différents résultats d’expérimentation indiquent que ces cellules ont un potentiel thérapeutique intéressant pour les traumatismes ou usures du cartilage comme l’arthrose, les pathologies touchant le système nerveux central et périphérique, les lésions cardiaques hypoxiques (infarctus) ou de dégénérescences musculaires, le rétablissement de la fonction hépatique (15).
Ces résultats permettent d’envisager des stratégies thérapeutiques visant par exemple à mobiliser les cellules souches résidentes de la pulpe afin d’amplifier le pouvoir naturel de réparation dentaire (9).
En effet, le phénomène de réparation dentinaire suscite la curiosité des scientifiques depuis de longues décennies. En réponse à une agression dentino-pulpaire, provoquant la dégénérescence des odontoblastes, des précurseurs pulpaires peuvent se différencier en odontoblastes de 2ème génération et former de la dentine réactionnelle. Cependant, si l’atteinte pulpaire est importante, les odontoblastes et les cellules de la couche sous-odontoblastique disparaissent et la dentine réparatrice est secrétée par les odontoblastes-like issues de la différenciation des cellules progénitrices ou cellules souches pulpaires.
Le recrutement d'une population de cellules souches, leur différenciation en une nouvelle génération de cellules odontoblastiques-like, conduisant à la dentinogenèse réparatrice, est une réponse physiologique du complexe dentino-pulpaire (3). Cependant, cette réponse physiologique, étant aléatoire et incontrôlée (10), pousse les chercheurs au recrutement dirigé des DPSCs /SHEDs.
L’induction des cellules souches dans la voie de différenciation choisie nécessite l’apport de facteurs d’induction adéquats. Le facteur de croissance le plus communément utilisé pour induire la différenciation des DPSCs en odontoblastes est la BMP2 (Bone Morphogenetic Protein 2). L’intérêt d’autres facteurs de croissances telles que TGFβ (Transforming Growth Factor), l'IGF (Insulin Growth Factor) ou la protéine BSP (Bone Sialo Protein) a également été démontré (2).
Placés au contact de la pulpe, ces facteurs provoquent le recrutement des DPSCs /SHEDs, qui se différencient et produisent une matrice minéralisée. Cette induction peut se faire de deux manières : les méthodes in vivo et ex vivo (2).
Le concept de l'ingénierie de l’organe dentaire a été montré potentiellement réalisable in vivo sur des modèles animaux (11). Le but ultime des chercheurs reste la reconstruction et l’implantation de l’organe dentaire chez l’homme.
Les études actuelles examinent également si une réparation parodontale totale peut être obtenue après une transplantation de cellules souches associées à un substitut osseux.
Lorsque les thérapeutiques conventionnelles mécaniques ou chirurgicales ne sont pas suffisantes, les techniques de régénérations cellulaires, à l’aide de dispositifs membranaires ou les amélogénines sont utilisées. Celles-ci ont pour objectifs de stimuler les cellules progénitrices ou les cellules souches présentent dans le parodonte résiduel. Cette stimulation va être dépendante de la sévérité des lésions, plus la destruction tissulaire sera avancée, plus les sources cellulaires seront diminuées (12).
Des études suggèrent que la culture des cellules souches du ligament parodontal résiduel (PDLSCs) sur un support matriciel est capable de régénérer un tissu semblable au complexe cément/ligament parodontal.
L’utilisation d’hydroxyapatite et de phosphate tricalcique comme support matriciel donne de bons résultats (13, 14).
L’utilisation de cellules souches afin de réparer les défauts osseux cranio-faciaux d’origines traumatiques, cancéreuses ou pathologiques peut être une alternative aux auto-allogreffes.
D’un point de vue plus général, l’utilisation possible des cellules souches dentaires dans le domaine médical est également étudiée.
Les différents résultats d’expérimentation indiquent que ces cellules ont un potentiel thérapeutique intéressant pour les traumatismes ou usures du cartilage comme l’arthrose, les pathologies touchant le système nerveux central et périphérique, les lésions cardiaques hypoxiques (infarctus) ou de dégénérescences musculaires, le rétablissement de la fonction hépatique (15).
BIBLIOGRAPHIE
1. Egusa H, Sonoyama W, Nishimura M, Atsuta I, Akiyama K. Stem cells in dentistry–part I: stem cell sources. Journal of prosthodontic research. 2012 ; 56(3) :151-165.
2. Renard E, Lopez-Cazaux S, Guicheux J, Weiss P, Laboux O, Alliot-Licht B. Les cellules souches de la pulpe dentaire. Comptes Rendus Biologies. Septembre 2007 Sept ; 330(9) : 635-643.
3. Gronthos S, Mankani M, Brahim J, Robey PG, Shi S. Postnatal human dental pulp stem cells (DPSCs) in vitro and in vivo. Proceedings of the National Academy of Sciences. 2000; 97(25):13625-13630.
4. Miura M, Gronthos S, Zhao M, Lu B, Fisher LW, Robey P G, Shi S. SHED: stem cells from human exfoliated deciduous teeth. Proceedings of the National Academy of Sciences.2003;100(10):5807-5812.
5. Suchánek J, Visek B, Soukup T, El-Din MSK., Ivancakova R, Mokry J, Omran A.Stem cells from human exfoliated deciduous teeth-isolation, long term cultivation and phenotypical analysis. Acta Medica (Hradec Kralove) 2010; 53(2):93-99.
6. Yildirim, S. Isolation Methods of Dental Pulp Stem Cells. In Dental Pulp Stem Cell. Springer New York. 2013 ; pp.41-51.
7. Kawashima N. Characterisation of dental pulp stem cells: A new horizon for tissue regeneration?. Archives of oral biology.2012;57(11) :1439-1458.
8. Dominici M, Le Blanc K, Mueller I, Slaper-Cortenbach I, Marini FC, Krause DS, Horwitz EM. Minimal criteria for defining multipotent mesenchymal stromal cells. The International Society for Cellular Therapy position statement. Cytotherapy.2006 ; 8(4) : 315-317.
9. Saber SEDM. Tissue engineering in endodontics. Journal of oral Science.2009 ; 51(4), 495-507.
10.Sloan AJ,Waddington RJ.Dental pulp stem cells: what, where, how?International Journal of Paediatric Dentistry.2009 ;19(1) :61-70.
11. Ohazama A, Modino SAC, Miletich I,Sharpe PT. Stem-cell-based tissue engineering of murine teeth. Journal of dental research. 2004 ; 83(7) : 518-522.
12. Chen FM, Sun HH, Lu H, Yu Q. Stem cell-delivery therapeutics for periodontal tissue regeneration. Biomaterials. 2012 ; 33(27) : 6320-44.
13. Kawaguchi H, Hirachi A, Hasegawa N et coll. Enhancement of periodontal tissue regeneration by transplantation of bone marrow mesenchymal stem cells. J Periodontol 2004;75(9):1281
14. Wei N, Gong P, Liao D et coll. Auto transplanted mesenchymal stromal cell fate in periodontal tissue of beagle dogs. Cytotherapy 2010;12(4):514
15-. Laberge T and Cheung HS. Multipotent Dental Stem Cells: An Alternative Adult Derived Stem Cell Source for Regenerative Medicine. Embryonic Stem Cells - Differentiation and Pluripotent Alternatives, ISBN 978-953-307-632-4, Michael S. Kallos ed.). Chapter 23, 451-472, 2011.
2. Renard E, Lopez-Cazaux S, Guicheux J, Weiss P, Laboux O, Alliot-Licht B. Les cellules souches de la pulpe dentaire. Comptes Rendus Biologies. Septembre 2007 Sept ; 330(9) : 635-643.
3. Gronthos S, Mankani M, Brahim J, Robey PG, Shi S. Postnatal human dental pulp stem cells (DPSCs) in vitro and in vivo. Proceedings of the National Academy of Sciences. 2000; 97(25):13625-13630.
4. Miura M, Gronthos S, Zhao M, Lu B, Fisher LW, Robey P G, Shi S. SHED: stem cells from human exfoliated deciduous teeth. Proceedings of the National Academy of Sciences.2003;100(10):5807-5812.
5. Suchánek J, Visek B, Soukup T, El-Din MSK., Ivancakova R, Mokry J, Omran A.Stem cells from human exfoliated deciduous teeth-isolation, long term cultivation and phenotypical analysis. Acta Medica (Hradec Kralove) 2010; 53(2):93-99.
6. Yildirim, S. Isolation Methods of Dental Pulp Stem Cells. In Dental Pulp Stem Cell. Springer New York. 2013 ; pp.41-51.
7. Kawashima N. Characterisation of dental pulp stem cells: A new horizon for tissue regeneration?. Archives of oral biology.2012;57(11) :1439-1458.
8. Dominici M, Le Blanc K, Mueller I, Slaper-Cortenbach I, Marini FC, Krause DS, Horwitz EM. Minimal criteria for defining multipotent mesenchymal stromal cells. The International Society for Cellular Therapy position statement. Cytotherapy.2006 ; 8(4) : 315-317.
9. Saber SEDM. Tissue engineering in endodontics. Journal of oral Science.2009 ; 51(4), 495-507.
10.Sloan AJ,Waddington RJ.Dental pulp stem cells: what, where, how?International Journal of Paediatric Dentistry.2009 ;19(1) :61-70.
11. Ohazama A, Modino SAC, Miletich I,Sharpe PT. Stem-cell-based tissue engineering of murine teeth. Journal of dental research. 2004 ; 83(7) : 518-522.
12. Chen FM, Sun HH, Lu H, Yu Q. Stem cell-delivery therapeutics for periodontal tissue regeneration. Biomaterials. 2012 ; 33(27) : 6320-44.
13. Kawaguchi H, Hirachi A, Hasegawa N et coll. Enhancement of periodontal tissue regeneration by transplantation of bone marrow mesenchymal stem cells. J Periodontol 2004;75(9):1281
14. Wei N, Gong P, Liao D et coll. Auto transplanted mesenchymal stromal cell fate in periodontal tissue of beagle dogs. Cytotherapy 2010;12(4):514
15-. Laberge T and Cheung HS. Multipotent Dental Stem Cells: An Alternative Adult Derived Stem Cell Source for Regenerative Medicine. Embryonic Stem Cells - Differentiation and Pluripotent Alternatives, ISBN 978-953-307-632-4, Michael S. Kallos ed.). Chapter 23, 451-472, 2011.