F. FAROUQ , C. MOUJOUD , L. KISSI , D. SARFI , I. BENYAHYA
Service d’Odontologie Chirurgicale, CCTD, Casablanca
Faculté de Médecine Dentaire de Casablanca
Université Hassan II – Maroc
RÉSUMÉ
Le risque hémorragique en chirurgie orale est considérable et peut être lié à l'acte chirurgical et aux antécédents médicaux du patient.
Une compréhension approfondie de la cascade de l’hémostase est essentielle pour anticiper et prévenir les complications hémorragiques. L'évaluation préopératoire minutieuse, combinée à une collaboration entre chirurgiens et médecins, permet d'adapter les traitements et d'assurer une prise en charge optimale, réduisant ainsi les risques pour le patient.
INTRODUCTION
L'hémorragie est une complication redoutée qui peut survenir lors de diverses procédures, allant des extractions dentaires simples aux interventions plus complexes. Comprendre le processus d'hémostase est donc essentiel pour évaluer et gérer efficacement les risques de saignement associés à ces interventions (1).
L’hémostase est l’ensemble des phénomènes biologiques conduisant à la formation d’un caillot sanguin pour mettre fin à un saignement. Ce processus comprend plusieurs étapes complexes, coordonnées par une cascade de réactions biochimiques. Cependant, certaines conditions médicales ou les effets secondaires de certains médicaments peuvent altérer la fonction plaquettaire, ralentir la coagulation ou provoquer une diminution des facteurs de coagulation, augmentant ainsi le risque d’hémorragie (1,2).
L’objectif de cet article est de détailler les diverses pathologies ainsi que l’influence de certains médicaments pouvant prédisposer le patient à un risque hémorragique en chirurgie orale, tout en précisant les procédures nécessaires pour leur prise en charge adéquate.
GÉNÉRALITÉS SUR L’HÉMOSTASE
L’hémostase est un processus physiologique déclenché par une lésion vasculaire. Elle implique des mécanismes biochimiques intracellulaires et l’activation des facteurs plasmatiques de la coagulation, circulant sous forme de précurseurs inactifs dans le sang (3,4).
L’hémostase physiologique, déclenchée par une lésion vasculaire, comporte trois étapes : l’hémostase primaire, la coagulation et la fibrinolyse.
L’hémostase primaire (3,4,5,6) :
L’hémostase primaire met en jeu les relations entre les plaquettes et la paroi vasculaire et conduit à un thrombus plaquettaire fragile et perméable. Son délai d’action est de 3 à 5 minutes. Elle se fait en deux temps : le temps vasculaire et le temps plaquettaire.
Le temps vasculaire (la vasoconstriction) : constitue la réponse immédiate à toute lésion vasculaire. Son action est renforcée par la sécrétion locale des facteurs comme l’endothéline, un puissant vasoconstricteur synthétisé par l’endothélium. En réduisant le débit sanguin, la vasoconstriction diminue pendant une brève période la perte sanguine. Elle est suivie rapidement par l’obturation de la plaie vasculaire par un thrombus plaquettaire.
La formation de ce thrombus plaquettaire comporte trois phases successives : l’adhésion plaquettaire, l’activation plaquettaire et l’agrégation plaquettaire.
Les plaquettes se fixent au collagène présent sur les berges de la plaie vasculaire, en présence d’un cofacteur, le facteur Von Willebrand. Cette protéine réalise un pont moléculaire entre le collagène exposé et les récepteurs situés sur la surface des plaquettes . Ces plaquettes forment initialement une monocouche recouvrant la brèche vasculaire et leur activation se fait en quelques secondes (10 à 20 s).
Une fois activées, les plaquettes libèrent plusieurs substances (facteurs de croissance, ADP, thromboxane …) ce qui renforce la vasoconstriction locale et favorise l’activation d’autres plaquettes circulantes. Ces plaquettes s'agrègent entre elles, sous l’action du fibrinogène et du facteur Von Willebrand, formant ainsi un agrégat plaquettaire ou un "clou plaquettaire".
La coagulation (3,4,5,6) :
La coagulation correspond à une cascade de réaction enzymatique dont la conséquence est la consolidation du thrombus plaquettaire.
Elle met en jeu différents éléments cellulaires tels que les plaquettes et les cellules endothéliales, ainsi que des facteurs de coagulation synthétisés principalement au niveau du foie. Ces facteurs sont désignés par des chiffres romains (Tableau 1), et certains d’entre eux (facteurs II, VII, IX et X) dépendent de la vitamine K pour acquérir leurs propriétés fonctionnelles. Haut du formulaire.
Les facteurs de coagulation interagissent avec les surfaces des plaquettes et des cellules endothéliales pour produire de la thrombine, enzyme clé dans la transformation du fibrinogène en fibrine.
Cette fibrine, initialement instable, se polymérise progressivement pour former un réseau insoluble sous l'action du facteur XIII activé par la thrombine. On obtient donc un caillot très stable, formé par des filets de fibrine, enserrant les plaquettes du thrombus blanc, soudés entre eux grâce au facteur XIII ainsi qu’au collagène exposé de la périphérie de la brèche vasculaire.
La fibrinolyse (3,4,5) :
La fibrinolyse est un phénomène physiologique local aboutissant à la destruction progressive du bouchon fibrineux. Ce phénomène est dû à la transformation du plasminogène, précurseur inactif synthétisé par le foie, en plasmine, enzyme protéolytique. La plasmine ainsi formée réalise la fibrinolyse proprement dite.
Dans la sphère orale, l’activité fibrinolytique sur les muqueuses est particulièrement élevée, en raison de l’abondante sécrétion d’activateurs de la fibrinolyse dans la salive. Le risque de dissolution prématurée d’un bouchon hémostatique est donc élevé.
| Numéro | Dénomination | Rôle |
| I | Fibrinogène | |
| II | Prothrombine | Précurseur de la thrombine |
| II | Facteur tissulaire | |
| IV | Calcium | |
| V | Proaccélérine | Cofacteur du Xa |
| VI | Phospholipides tissulaires | |
| VII | Proconvertine | |
| VIII | Antihémophilique A | Cofacteur du IXa |
| IX | Antihémophilique B | Rôle +++ dans les voies de la coagulation |
| X | Facteur Stuart | Le Xa génère la thrombine |
| XI | Facteur Rosenthal | Le XIa active le IX |
| XII | Facteur Hageman | Génère le XIa |
| XIII | Stabilise la fibrine |
Tableau 1 : Facteurs de coagulation.
CLASSIFICATION DES ACTES EN CHIRURGIE ORALE
La société française de chirurgie orale (SFCO) a classé les actes en chirurgie orale en fonction de la sévérité du saignement et la complexité de la procédure. Il convient de distinguer (7) :
|
Type de chirurgies et actes invasifs |
Mesures préventives des complications hémorragiques |
|
Actes sans risque hémorragique |
|
|
● Anesthésie locale ● Détartrage |
- Hémostase mécanique simple par pression |
|
Chirurgies et actes à faible risque hémorragique Les chirurgies pour lesquelles une hémorragie extériorisée est facilement contrôlable par une hémostase chirurgicale conventionnelle |
|
|
● Avulsion simple ● Avulsions multiples dans 1 même quadrant ● Chirurgie endodontique, périapicale, énucléation de kystes et tumeurs bénignes (lésion < 3cm) ● Chirurgie muco-gingivale (hors greffe gingivale avec prélèvement palatin) ● Chirurgie pré-orthodontique d’une dent enclavée, incluse ● Implant unitaire ● Dégagement implant(s) (pilier cicatrisation) ● Biopsie-exérèse muqueuse orale (≤1 cm)
|
- Mesure d’hygiène bucco-dentaire et détartrage - Hémostase chirurgicale conventionnelle - Acide tranexamique |
|
Chirurgies et actes invasifs à risque hémorragique élevé Chirurgies pour lesquelles des pertes sanguines significatives et/ou transfusions plaquettaires sont rapportées dans la littérature, interventions d’une durée opératoire > 1 heure, interventions critiques par leurs localisations (sinus maxillaire, plancher buccal) et/ou difficilement contrôlables par une hémostase chirurgicale conventionnelle ) |
|
|
● Avulsions multiples dans plusieurs quadrants ● Avulsion de dent(s) incluse(s) ● Implants multiples dans plusieurs quadrants ● Elévation du sinus (voie crestale, voie latérale) ● Greffes osseuses d’apposition (en onlay) ● Greffe osseuse particulaire et régénération osseuse guidée ● Chirurgie des tissus mous (lithiase salivaire) ● Chirurgie endodontique, périapicale, énucléation de kystes et tumeurs bénignes (lésion > 3cm) ● Fermeture d’une communication bucco-sinusienne ● Exérèse des pseudotumeurs et tumeurs bénignes de la muqueuse buccale (> 1 cm) |
- Même mesure préventive que pour une chirurgie à risque hémorragique faible à modéré - Médicaments dérivés du sang, à base de fibrinogène ou thrombine humains - Electrocoagulation mono et bipolaire - Privilégier les chirurgies mini-invasives (flapless et chirurgie implantaire guidée, abord du sinus par vois crestale…) - Imagerie 3D préopératoire (sinus, région symphysaire) en cas de pose d’implant
|
LES DÉSORDRES PLAQUETTAIRES
Les désordres plaquettaires sont des affections qui touchent les plaquettes sanguines, les cellules essentielles à la formation du caillot sanguin.
Ces désordres sont classés selon qu’ils relèvent d’une anomalie quantitative (thrombopénie) ou d’une anomalie fonctionnelle (thrombopathie congénitale, thrombopathie acquise) (8,9).
La thrombopénie correspond à une numérisation plaquettaire ≤ 150 000/μl. Elle peut être d’origine centrale suite à la diminution de la production médullaire des plaquettes (anémie aplasique, chimiothérapie anticancéreuse, hémopathies malignes) ou périphérique suite à destruction accrue des plaquettes (purpura thrombopénique immunologique). Elles se manifestent par un allongement du temps de saignement, le plus souvent, proportionnel à l’intensité de la thrombopénie.
La prise en charge de ces patients nécessite d’abord une évaluation de la numérisation plaquettaire.
En cas de thrombopénie modérée (entre 50000/μL et 100 000/μL), l’acte chirurgical peut être réalisé. Ces actes se feront sous contrôle du saignement grâce à l’usage de techniques rigoureuses locales d’hémostase.
En cas de thrombopénie sévère (<50000/μL), une transfusion plaquettaire prophylactique, 30 minutes avant des soins chirurgicaux est indiquée. Les moyens locaux d’hémostase sont également requis (8,9,10).
Les thrombopathies se définissent par une altération fonctionnelle des plaquettes. Elles se traduisent par un allongement du temps du saignement et des anomalies pouvant être objectivées par agrégométrie, sans thrombopénie associée.
Elles peuvent être d’origine congénitale (thrombasténie de Glanzmann, syndrome de Bernard-Soulier…) ou acquise (thrombopathie médicamenteuse).
Les thrombopathies congénitales sont variées. La thrombasténie de Glanzmann affecte les glycoprotéines membranaires des plaquettes impliquées dans la fixation du fibrinogène. Le syndrome de Bernard-Soulier se caractérise par des plaquettes de grandes tailles entrainant une déficience d’adhésion par défaut du récepteur GPIb alpha.
En cas de thrombopathie modérée ou sévère, une transfusion plaquettaire peut être nécessaire si des actes sont à haut risque hémorragique. Cependant, dans la pratique, on essaiera d’éviter au maximum ce recours à cause du risque d’immunisation. Le contrôle du saignement sera donc réalisé rigoureusement par des techniques locales d’hémostase chirurgicale après l’accord du médecin traitant (12,13,14,15).
Les thrombopathies acquises sont principalement médicamenteuses suite à la prescription des antiagrégants plaquettaires (AAP). Ils sont utilisés dans la prévention et le traitement des thromboses artérielles et des maladies cardio-vasculaires. Les principaux médicaments antiplaquettaires actuellement utilisés sont Aspirine, Clopidogrel, Prasugrel et Ticagrelor.
- - L’aspirine ou acide acétylsalicylique (KARDEGIC*) bloque la cyclo-oxygénase-1 de la plaquette, ce qui inhibe la production de la Thromboxane A2, un puissant inducteur de l’agrégation plaquettaire. Après l’interruption de l’aspirine, l’agréabilité plaquettaire se normalise en 7 à 10 jours.
- - Le Clopidogrel (PLAVIX*) agit par inhibition, de manière irréversible, des récepteurs de l’adénosine diphosphate sur les membranes des plaquettes, ce qui retarde leur agrégation. Les modes d’action de l’Aspirine et de Copidogrel étant différents, leur combinaison suggère une grande efficacité antithrombotique.
- - Le Prasugrel et le Ticagrelor sont des AAP de nouvelle génération, souvent prescrits en association avec l’aspirine. Leur mode d'action est similaire à celui du clopidogrel, mais ils présentent deux avantages par rapport à ce dernier : un début d’action plus rapide et une activité plus puissante (5,7,16,17).
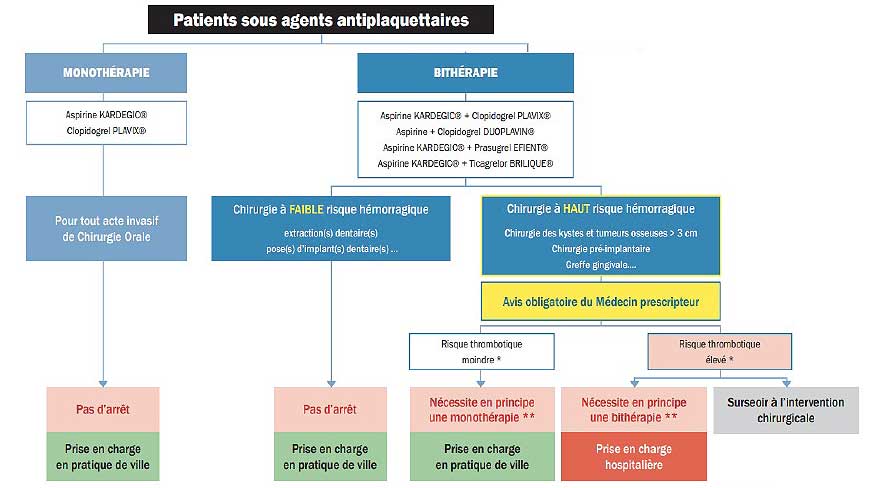 |
Fig 1 : Algorithme de prise en charge des patients sous AAP en chirurgie orale selon la SFCO.
Jusqu’à présent, il n’existe pas d’examen biologique prédictif du risque hémorragique chirurgical lié à la prise d’un AAP.
Selon les recommandations de la SFCO pour la prise en charge des patients sous AAP par voie orale (Fig 1), il est recommandé de maintenir le traitement par AAP en monothérapie, quel que soit le risque hémorragique de l’acte chirurgical afin de prévenir le risque thrombotique (7).
En cas de bithérapie, les actes à faible risque hémorragique peuvent être réalisés sans arrêter le traitement, mais en cas de chirurgie à risque hémorragique élevé, le contact avec le médecin prescripteur devient indispensable. Selon le risque thrombotique du patient, le médecin décidera de maintenir la bithérapie ou réalisera un arrêt partiel. Une prise en charge hospitalière pourra alors être nécessaire (7).
LES TROUBLES DE COAGULATION
La coagulation peut être affectée par des troubles dus à un déficit d’un ou de plusieurs facteurs de coagulation, aboutissant à des coagulopathies, qui peuvent être constitutionnelles (Hémophilie et maladies de Willbrand) ou acquises (coagulopathies médicamenteuses, insuffisance hépatique).
Hémophilie et maladie de Willbrand
Les hémophilies sont des maladies constitutionnelles de la coagulation due à un déficit en facteur VIII (Hémophilie A) ou IX (hémophilie B). L’hémophilie est classée en 3 formes (la gravité du syndrome hémorragique dépend de la sévérité du déficit) :
- - mineure : dosage du facteur compris entre 5 % et 25 %,
- - modérée : dosage du facteur compris entre 1 % et 5 %,
- - majeure : dosage du facteur <1 %
La maladie de Willebrand est également une pathologie constitutionnelle de l’hémostase, conséquence d’un défaut génétique du facteur de Willebrand (vWF). Ce facteur joue un rôle dans l'agrégation et l'adhésion plaquettaire, ainsi que dans le transport plasmatique du facteur VIII, essentiel à la cascade de coagulation.
On distingue 3 trois types :
- - le type 1 lié à un déficit quantitatif partiel en vWF,
- - le type 2 lié à un déficit qualitatif en vWF,
- - le type 3 lié à un déficit total en vWF.
Tout patient présentant une hémophilie ou maladie de Willbrand doit être pris en charge dans une structure hospitalière et nécessite au moment de la consultation, la mise en place d’un protocole conjoint (traitement substitutif) avec le service d’hématologie pour cadrer le geste chirurgical. Le traitement substitutif repose sur l’injection de concentrés de facteurs (VIII/IX) d’origine plasmatique ou recombinante ou de facteur de vWB .
Dans les formes mineures d’hémophilie A ou de type 1 de maladie de Willbrand, l’injection de la desmopressine permet souvent de corriger de façon transitoire le déficit en facteur.
Après l’intervention chirurgicale, les moyens locaux d’hémostase sont requis ainsi qu’une prescription d’acide tranexamique et le maintien postopératoire du facteur est nécessaire et la durée dépend du taux du facteur administré (18,19,20,21,22,23,24).
Les coagulopathies acquises médicamenteuses :
L'utilisation des anticoagulants est courante dans la gestion des thromboses actives ou de la prévention des complications thromboemboliques chez les patients présentant une fibrillation auriculaire, des valves cardiaques mécaniques, des thromboembolies veineuse ou une embolie pulmonaire. On distingue des anticoagulants oraux (les antivitamines K, les anticoagulants oraux directs ) et injectables (Héparine) (25).
Les Antivitamines K (AVKs) :
Les AVKs constituent le traitement anticoagulant de référence proposé depuis plusieurs décennies. Il en existe deux types : Les dérivés coumariniques : Warfarine (Coumadine®), l’acenocoumarol (Sintrom®) et les dérivés de l’indanedione : la fluindione (Previscan®). Ces produits ont le même mode d’action, mais diffèrent par leurs propriétés pharmacocinétiques, notamment leurs demi-vies (26,27,28).
Les AVKs sont captés progressivement par les hépatocytes, où ils bloquent le cycle d’oxydo-réduction de la vitamine K. Cette inhibition perturbe la synthèse hépatique des facteurs de coagulation II, VII, IX et X, qui dépendent de la vitamine K, ainsi que de deux inhibiteurs, les protéines C et S. L’effet anticoagulant des AVK est progressif et se manifeste généralement après 48 à 72 heures et peut persister même après l’arrêt du traitement en raison de leur longue durée d’action (26,27,28).
Pour tout acte chirurgical, un INR (international normalized ratio) doit être réalisé, idéalement dans les 24 heures, au maximum dans les 72 heures précédant l’intervention chirurgicale, afin d’explorer le risque hémorragique du patient (7).
Selon les recommandations de la SFCO (Fig 2), la poursuite du traitement par AVK est recommandée en cas de chirurgie orale à faible risque hémorragique, tant que la valeur de l’INR est inférieure à 4, et en utilisant une hémostase appropriée.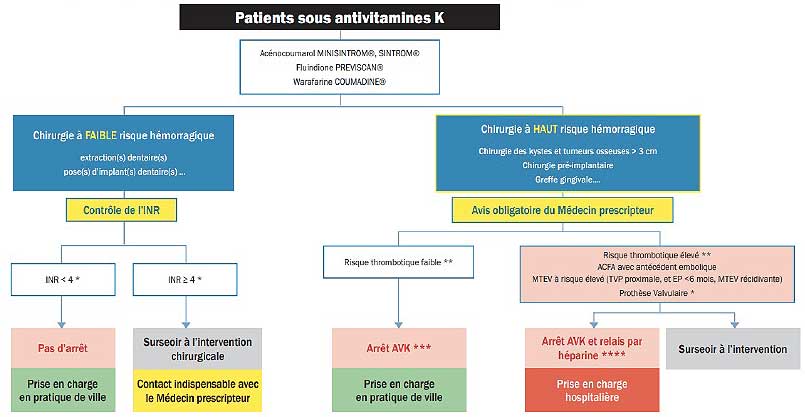
Fig 2 : Algorithme de prise en charge des patients sous AVK en chirurgie orale selon la SFCO.
En cas de surdosage (INR supérieur ou égal à 4) ou d’INR instable, l’intervention chirurgicale doit être reportée et le médecin prescripteur informé. Des mesures correctrices doivent être instaurées sans délai par le médecin prescripteur afin de ramener l’INR en zone thérapeutique (7).
Pour une chirurgie orale à risque hémorragique élevé, l’avis du médecin prescripteur est indispensable afin d’évaluer le risque thrombotique. Si le risque thrombotique est faible, une fenêtre thérapeutique de 48 à 72 heures peut être proposée par le médecin prescripteur : Les AVK doivent être arrêtés 24 à 48 heures avant l’intervention chirurgicale (24 heures pour l’acénocoumarol et 48 heures pour la coumadine ou la fluindione), l’INR contrôlé en préopératoire avec pour objectif une valeur inférieure ou égale à 1,5 et une reprise des AVK dès que possible au plus tard dans les 24 à 48 heures postopératoires (7).
En cas d’un risque thrombotique élevé, l’instauration en milieu hospitalier d’un relais pré et postopératoire du traitement AVK par une héparine (héparine de bas poids moléculaire ou non fractionnée) à dose curative est possible, mais doit rester exceptionnelle (7).
Les prescriptions médicamenteuses pré et postopératoires peuvent parfois interagir avec les AVK, entraînant une élévation de l'INR. Pour le contrôle de la douleur, le paracétamol et les dérivés opiacés peuvent être prescrits. L’aspirine et les anti-inflammatoires non stéroïdiens (AINS) sont contre-indiqués, car ils exposent à un risque hémorragique majoré. L’antibioprophylaxie de 2 g d’amoxicilline ou 600 mg de clindamycine une heure avant l’intervention ne modifie pas la valeur de l’INR (7).
Les anticoagulants oraux directs (AOD) :
Les anticoagulants oraux directs (AOD), introduits en 2009, représentent une alternative moderne aux antivitamines K (AVK) pour la prévention et le traitement de la fibrillation auriculaire non valvulaire et des accidents thromboemboliques veineux. Ils agissent de manière plus spécifique sur la cascade de coagulation, en inhibant directement la thrombine (facteur IIa) pour le Dabigatran ou le facteur Xa pour l’Apixaban et le Rivaroxaban (17,25).
Ils offrent une action plus rapide et prévisible, nécessitant moins de surveillance biologique et présentant moins d'interactions alimentaires et médicamenteuses. Cependant, les tests biologiques disponibles ne sont pas suffisants pour mesurer précisément le degré d'anticoagulation qu'ils induisent (29,30).
Selon les recommandations de la SFCO (Fig 3), la prise en charge des patients sous AOD varie en fonction du risque hémorragique de l’intervention (7).
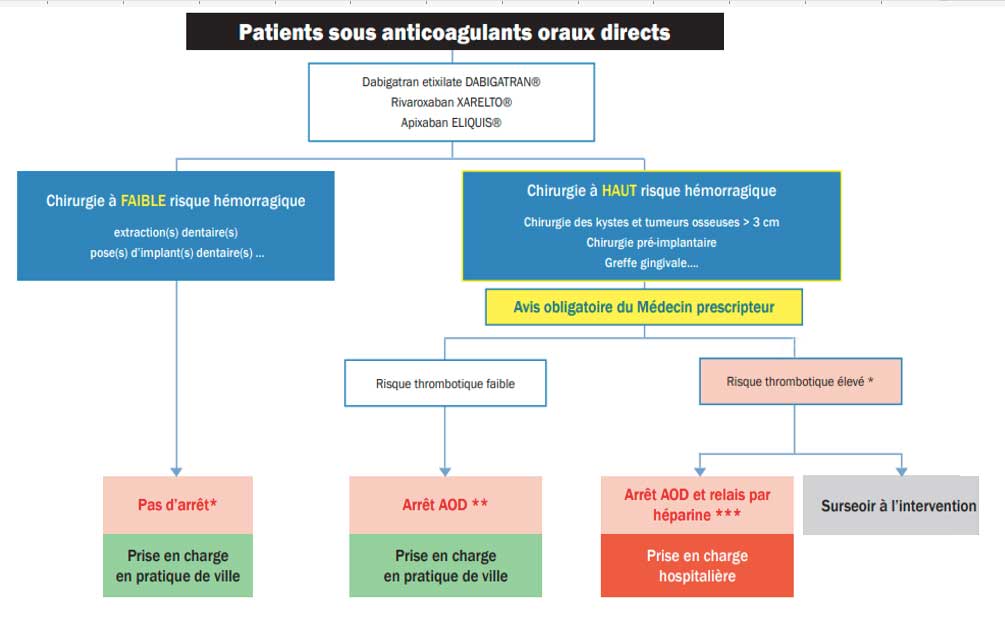 |
Fig 3 : Algorithme de prise en charge des patients sous AOD en chirurgie orale selon la SFCO.
En cas de chirurgie à faible risque hémorragique, la poursuite du traitement par AOD est recommandée.
En cas de chirurgie orale à risque hémorragique élevé, l’avis du médecin prescripteur est indispensable afin d’évaluer le risque thrombotique. En cas de risque thrombotique faible, les AOD peuvent être arrêtés par le médecin la veille de l’intervention et repris le lendemain de l’intervention (fenêtre thérapeutique de 48 h). Dans les rares cas de chirurgie à risque hémorragique élevé chez un patient présentant un risque thrombotique élevé, un arrêt plus prolongé du traitement par AOD avec un relais héparinique en milieu hospitalier est possible, mais doit rester exceptionnel (7).
L’héparine :
L'héparine est un anticoagulant naturellement présent dans les granules sécrétoires des mastocytes. Il existe deux principaux types d'héparine : l'héparine non fractionnée et l'héparine de bas poids moléculaire (31).
L'héparine non fractionnée (HNF) inhibe l'antithrombine III ainsi que plusieurs facteurs de coagulation (IXa, Xa, XIa, XIIa et la thrombine). Elle est indiquée dans la prophylaxie et le traitement des maladies thromboemboliques, telles que la thrombose veineuse profonde (TVP), l'embolie pulmonaire, la fibrillation auriculaire avec embolie et en hémodialyse. Elle est administrée par perfusion intraveineuse ou injection sous-cutanée et nécessite un suivi étroit via le temps de thromboplastine partielle activée (aPTT).
Les héparines de bas poids moléculaire (HBPM), inhibent principalement le facteur Xa et, dans une moindre mesure, la thrombine. Elles sont utilisées pour des indications similaires à l'HNF, ainsi que dans le traitement de l'infarctus du myocarde aigu (IMA) et comme adjuvant lors d'interventions coronariennes percutanées. La surveillance des HBPM n'est généralement pas requise, bien qu'un dosage de l'activité anti-facteur Xa puisse être effectué si nécessaire (31).
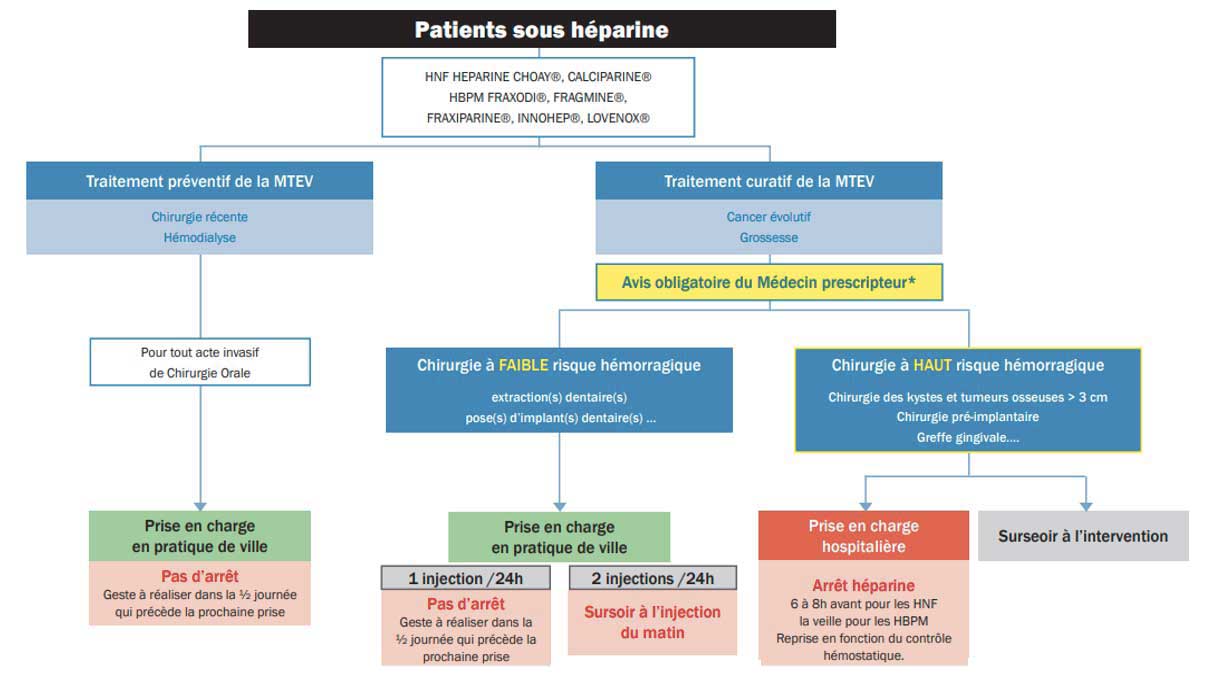 |
Fig 4 : Algorithme de prise en charge des patients sous héparine en chirurgie orale selon la SFCO.
Selon la SFCO (Fig 4), la poursuite du traitement par une héparine (HBPM ou HNF) est recommandée en cas de chirurgie orale à faible risque hémorragique, à condition de réaliser l’acte dans la demi-journée qui précède la prochaine prise.
En cas de chirurgie orale à risque hémorragique élevé, les héparines peuvent être arrêtées par le médecin prescripteur avant l’intervention (6 à 8 heures avant l’intervention pour les héparines non fractionnées et 24 heures avant pour les héparines de bas poids moléculaire) afin de limiter le risque de saignement péri-opératoire (7).
L’insuffisance hépatique :
L’insuffisance hépatique se définit comme l’ensemble des manifestations cliniques et biologiques secondaires à l’altération des fonctions du foie. Parmi ses fonctions essentielles, le foie est responsable de la synthèse des facteurs de coagulation et de la production de thrombopoïétine, une hormone qui régule la production de plaquettes dans la moelle osseuse. De plus, une insuffisance hépatique peut entraîner une malabsorption de la vitamine K, indispensable à la formation de certains facteurs de coagulation. Ces perturbations augmentent significativement le risque hémorragique chez les patients (2).
Pour anticiper ce risque hémorragique, le taux de prothrombine et le taux des plaquettes destinés à détecter ces troubles seront vérifiés avant tout type d’intervention chirurgicale (32).
En ce qui concerne le taux de prothrombine (32) :
• Entre 70 et 100 % : ces soins peuvent être réalisés selon les protocoles habituels,
• Entre 30 et 70 % : des moyens d’hémostase locaux doivent être utilisés,
• En dessous de 30 % : en cas de nécessité absolue, aucune intervention n’est possible, le risque hémorragique étant trop important : l’intervention sera réalisée en milieu hospitalier (après concertation avec le médecin traitant).
En ce qui concerne le taux de plaquettes (32) :
• >100000/mm3 : Il n'y a aucune précaution particulière à prendre,
• Compris entre 50 000 et 100 000/mm3 : Des moyens d’hémostase locaux doivent être utilisés,
• < 50 000/mm3 : on ne peut intervenir qu’en cas de nécessité absolue en milieu hospitalier après transfusion plaquettaire.
CONCLUSION
La gestion du risque hémorragique en chirurgie orale nécessite une compréhension approfondie des mécanismes de l’hémostase et une évaluation rigoureuse des facteurs de risque propres à chaque patient. Les désordres plaquettaires, les coagulopathies constitutionnelles ou acquises, ainsi que l’utilisation d’anticoagulants et d’antiagrégants plaquettaires, imposent des précautions spécifiques pour prévenir les complications hémorragiques.
Une collaboration étroite entre le chirurgien et le médecin prescripteur est essentielle pour ajuster les traitements et garantir une prise en charge sécurisée.
BIBLIOGRAPHIE
- Natália de Campos et al. Bleeding in dental surgery Contemporary Applications of Biologic Hemostatic Agents across Surgical Specialties - Volume 2 2019
DOI: 10.5772/intechopen.89992
- Sukina Moosajee et al. Dental management of patients with acquired and congenital bleeding disorders Prim Dent J. 2020;9(2):47-55 DOI: 1177/2050168420923866
- Yassin Nizamaldin et al. Hémostase locale en chirurgie orale. 1ère partie : physiologie de l’hémostase Med Buccale Chir Buccale 2012;18:119-127
DOI: 10.1051/mbcb/2009037
- De Revel et al (2004). The Normal Haemostatic Process EMC - Dentisterie, 1(1), 71–81. doi:10.1016/j.emcden.2003.05.001
- Ana Mingarro-de-León et al. Dental management of patients receiving anticoagulant and/or antiplatelet treatment Clin Exp Dent. 2014 Apr 1;6(2):e155-61. doi: 10.4317/jced.51215
- Amit Mani et.al. Hemostatic Agents in Dentistry Galore International Journal of Health Sciences and Research (www.gijhsr.com) 40 Vol.3; Issue: 4; October-December 2018
- SFCO / Gestion péri-opératoire des patients traités par antithrombotiques en chirurgie orale / Argumentaire/ Juillet 2015
- Jumana Karasneh et al. World Workshop on Oral Medicine VII: Platelet count and platelet transfusion for invasive dental procedures in thrombocytopenic patients: A systematic review Oral Dis 2019 Jun:25 Suppl 1:174-181.doi: 10.1111/odi.13082.
- Wobke E M va n Dijk et al. Dentoalveolar Procedures in Immune Thrombocytopenia; Systematic Review and an Institutional Guideline TH Open. 2021 Sep 9;5(4):e489-e502.doi: 10.1055/a-1641-7770.eCollection 2021 Oct.
- PHILLIP SO et al, Dental extraction is probably safe for patients with thrombocytopenia: the standard of care is a guide for clinical decision making related to platelet transfusion J Oral Maxillofac Surg. 2013 Oct;71(10):1647-1652. doi:10.1016/j.joms.2013.05.011.
- Shaiba Sandhu et al, Bleeding risk in thrombocytopenic patients after dental extractions: a retrospective single-center study Oral Surg Oral Med Oral Pathol Oral Radiol. 2020 May;129(5):478-483. doi: 10.1016/j.oooo.2019.12.010.Epub 2020 Jan 27
- Lise J Estcourt et al. Guidelines for the use of platelet transfusions Br J Haematol. 2017 Feb;176(3):365-394.doi: 10.1111/bjh.14423.
- Rocco Franco et al , Glanzmann’s Thrombastenia: The Role of Tranexamic Acid in Oral Surgery Case Rep Dent. 2018 Sep 5; 2018:9370212 doi: 10.1155/2018/9370212
- Karasneh J et al, World Workshop on Oral Medicine VII: Bleeding Control Interventions for Invasive Dental Procedures in Patients with Inherited Functional Platelet Disorders: A Systematic Review Oral Surg Oral Med Oral Pathol Oral Radiol. 2022 Apr;133(4):412-431. doi: 10.1016/j.oooo.2021.08.003.
- Bruno EK, Bennett JD. Platelet Abnormalities in the Oral Maxillofacial Surgery Patient. Oral Maxillofac Surg Clin North Am. 2016 Nov;28(4):473-480. doi: 10.1016/j.coms.2016.06.001
- Bruno EK, Bennett JD. Platelet Abnormalities in the Oral Maxillofacial Surgery Patient. Oral Maxillofac Surg Clin North Am. 2016 Nov;28(4):473-480. doi: 10.1016/j.coms.2016.06.001
- Martinez M, Tsakiris DA. Management of Antithrombotic Agents in Oral Surgery Maria Martinez and Dimitrios A. Tsakiris. Dent J (Basel). 2015 Oct 6;3(4):93-101. doi: 10.3390/dj3040093.
- Martha Cecilia Elizondo Rojas et al . Hemophilia and its considerations in the dental practice. Int. J. Appl. Sci. 2022;8(1):65-69. DOI: 10.22271/oral.2022.v8.i1b.1408
- Bajkin B, Dougall A. Current state of play regarding dental extractions in patients with haemophilia: Consensus or evidence-based practice? A review of the literature. Haemophilia. 2020 Mar;26(2):183-199. doi: 10.1111/hae.13928
- Mukul SK, Agrawal A. Management of Hemophilia: A Dental consideration. J Orofac Res. 2018;7(3):27-31.
- Srivastava A, Santagostino et al ; WFH Guidelines for the Management of Hemophilia panelists and co-authors. WFH Guidelines for the Management of Hemophilia, 3rd edition. Haemophilia. 2020 Aug;26 Suppl 6:1-158. doi: 10.1111/hae.14046
- AnnieHarroche et al, Maladie de Willebrand et prévention du risque hémorragique en chirurgie Volume 22, Issue 6, December 2018, Pages 326-334 https://doi.org/10.1016/j.pratan.2018.10.006
- Fénelon M, Castet S, Fricain JC, Catros S. Guided Implant Surgery to Reduce Morbidity in Von Willebrand Disease Patients: A Case Report. Open Dent J. 2018 Jan 31;12:80-86. doi: 10.2174/1874210601812010080
- Moosajee S, Rafique S. Dental Management of Patients With Acquired and Congenital Bleeding Disorders. Prim Dent J. 2020 Jun;9(2):47-55. doi: 10.1177/2050168420923866
- Thean D, Alberghini M. Anticoagulant therapy and its impact on dental patients: a review. Aust Dent J. 2016 Jun;61(2):149-56. doi: 10.1111/adj.12344. Erratum in: Aust Dent J. 2016 Dec;61(4):526. doi: 10.1111/adj.12468
- Kämmerer PW, Frerich B, Liese J, Schiegnitz E, Al-Nawas B. Oral surgery during therapy with anticoagulants-a systematic review. Clin Oral Investig. 2015 Mar;19(2):171-80. doi: 10.1007/s00784-014-1366-3.
- Felix J, Chaban P, Ouanounou A. Dental Management of Patients Undergoing Antithrombotic Therapy. J Can Dent Assoc. 2020 Dec;86:k17. PMID: 33326372.
- Akram BELMEHDI et al, Les particularités de la prise en charge des patients sous antivitamines K : mise au point EDP Sciences l AOS 2017 l https://doi.org/10.1051/aos/2017045
- Doonquah L, Mitchell AD. Oral surgery for patients on anticoagulant therapy: current thoughts on patient management. Dent Clin North Am. 2012 Jan;56(1):25-41, vii. doi: 10.1016/j.cden.2011.06.002
- Statman BJ. Perioperative Management of Oral Antithrombotics in Dentistry and Oral Surgery: Part 1. Anesth Prog. 2022 Fall;69(3):40–7. doi: 10.2344/anpr-69-03-05.
- Pasquale LD, Ferneini EM. Heparin and Lovenox: What the Oral and Maxillofacial Surgeon Needs to Know. Oral Maxillofac Surg Clin North Am. 2016 Nov;28(4):507-513. doi: 10.1016/j.coms.2016.06.008
- IBOURK, S. HAITAMI, I. BEN YAHYA Patients atteints de l’insuffisance hépatique : Manifestations buccales et prise en charge. Courrier du dentiste 2018.








