M. SIDQUI, K. AMINE, J. KISSA
Service de parodontologie
Faculté de Médecine Dentaire de Casablanca
Université Hassan II
RÉSUMÉ
A l'instar des organes nobles tels le cœur, les poumons ou les vaisseaux, le milieu buccal en général et le parodonte en particulier ne sont pas épargnés par les méfaits du tabagisme. Plusieurs études cliniques et épidémiologiques ont montré une corrélation entre la consommation du tabac et la prévalence de la maladie parodontale, suggérant ainsi que le tabac inhalé constitue un facteur de risque majeur des maladies parodontales, voire même un facteur aggravant surtout si la consommation du tabac est importante et l'habitude est ancienne.
Mots-clés : Parodonte, Tabac.
Lorsqu'on parle dans le public de la toxicité du tabac, celui-ci pense immédiatement à la relation tabac-cancer du poumon et à la bronchite chronique. Et pourtant, le tabac intéresse d'abord la cavité buccale par laquelle il transite, puisqu'il est actuellement reconnu comme un facteur de risque pour les cancers de la cavité buccale et pour plusieurs maladies cardio-vasculaires. Des clichés cliniques récents ont confirmé le rôle du tabac inhalé comme un facteur de risque majeur de la maladie parondontale (Haber et coll. 1993(1); Berstrom et Preber. 1994(2); Salvi et coll. 1997) (3).
Les fumeurs ont une destruction parodontale plus sévère que les non fumeurs (Ismail et coll. 1983(4) ; Feldman et coll. 1983(5) ; Bergstrom 1989(6) ; Bergstrom et coll. 1991(7)) puisque le fait de fumer représenterait un risque d'atteinte 2 à 14 fois plus important qu'en l'absence du tabagisme et, dans une des études (Grossi et coll., 1994(8), on a même signalé que le groupe de sujets sains ne comprenait aucun fumeur.
D'autres auteurs ont montré également que certains types de maladies parodontales comme la parondontite réfractaire (Mac Farlane et coll. 1992(9) ; Bergstrom et Blomlof 1992(10)) et la gingivite ulcéro-nécrotique (GUN) (Johnson et Engel 1986(11) sont également associées au tabac. Le but de ce travail est de mettre en évidence et d'analyser l'influence du tabac sur la prévalence et la sévérité des maladies parodontales.
COMPOSITION DE LA FUMÉE DE TABAC
Dans la composition chimique du tabac, on différencie des centaines de substances différentes, dont certaines se situent à des concentrations pouvant s'avérer préjudiciables pour la santé (Haber et Kent. 1992(12), Haber et coll. 1993(1), Lagrue . 1992 (13)).
La fumée du tabac comprend une phase gazeuse et une phase particulaire :
- les gaz contiennent, en outre, un grand nombre de substances telles le dioxyde et le monoxyde de carbone, l'ammoniaque, mêlés à l'oxygène et l'azote de l'air inspiré ;
- les particules sont constituées de gouttelettes liquides ainsi que d'éléments solides microscopiques en suspension de diamètre entre 16 et 18 mm.
INCIDENCE DU TABAC SUR LE SYSTÈME PARODONTAL
Actions spécifiques du tabac sur le milieu buccal
Action spécifique sur la salive
Sécrétion salivaire :
Le tabagisme possède une action incontestable sur la salivation, puisqu'il coexiste une augmentation significative de la production de la salive, et en particuliers, la salive parotidienne qui suit immédiatement l'exposition à la fumée du tabac. Parallèlement, les concentrations en calcium, en potassium, en phosphate et en acide thiocyanique salivaires sont augmentées, le potentiel d'oxydoréduction est diminué, ceci favorise donc la formation de la plaque bactérienne et sa minéralisation (Mac Gregor et Edgar. 1986)(14).
Le pH :
Plusieurs études ont montré que la fumée du tabac entraîne une alcalinisation immédiate du milieu buccal (Mac Gregor et Edgar. 1986)(14).
Les leucocytes :
Les leucocytes contenus dans la salive permettent une défense du milieu buccal. Eidrel et Sharick en 1969 (15) ont montré une diminution de l'activité leucocytaire intrabuccale induite par le tabac.
Haleine du fumeur :
Cette halitose peut être dûe à l'odeur du tabac ou bien à la modification de la qualité et de la quantité salivaire, ainsi que l'équilibre de la flore buccale, ou alors rentrant dans le cadre d'une gingivo-stomatite ou d'une atteinte néoplasique due au tabac.
Action du tabac sur le système immunitaire
D'une manière générale, l'usage du tabac réduit la réponse immunitaire et altère ses fonctions chez l'homme. Ses composants solubles entraînent une altération de la résistance de l'hôte, en diminuant la production d'anticorps et en supprimant la prolifération des lymphocytes (Mac Farlane et coll. 1992(9)), ainsi que l'activité phagocytaire et la capacité chimiolytique des Polymorphonu-cléaires (PMN) (Kenny et coll. 1975)(16). En effet, des taux décroissants des Ig G, Ig A et Ig M ont été observés chez les fumeurs, avec une augmentation des Ig E (Gerrand et coll. 1980)(17) ; (Johnson et coll. 1990)(18). La variabilité des réactions chimiotactiques et phagocytaires est influencée par la consommation du tabac (Mac Farlane et coll. 1992)(9).
Action du tabac sur le fluide gingival
Plusieurs études ont montré que le flux du fluide gingival était perturbé chez les fumeurs, comparés aux non fumeurs. En effet, Bergstrom et Preber en 1986(19) ont montré que les mesures de la concentration du fluide gingival étaient significativement plus basses chez les fumeurs, comparés aux non fumeurs. D'autres études (Linden et Mullally. 1994)(20) ont montré que le tabagisme produit une augmentation marquée mais passagère du flux du fluide gingival, ce qui refléterait les variations connues du flux sanguin produites par la nicotine.
Tabac et état parodontal
Tabac et indice de plaque
Plusieurs auteurs comme Sheiman, 1971(21), puis Modeer et coll, 1980 (22) ont affirmé que les fumeurs présentent plus de plaque et de tartre que les non fumeurs. Cependant Sheiman, 1971(21) ajoute qu'à hygiène égale, le degré d'inflammation parodontale est équivalent dans les deux groupes, alors que d'autres équipes (Bastian et Waite. 1978)(23); (Swenson, 1973)(24) n'ont révélé aucune différence concernant le dépôt de plaque entre les sujets fumeurs et non fumeurs. En effet, le fait de fumer ne semble pas interférer avec le développement de la plaque mais influence le mécanisme d'adhésion de cette dernière, puisqu'il y a une augmentation significative du taux des ions Ca++ chez les fumeurs (Mac Gregor et Ruggy-Gunn.1986)(25).
Tabac et indice gingival
Les études évaluant les signes de la gingivite chez les fumeurs se montrent contradictoires. Preber et coll,1980(26) ont montré une augmentation de l'inflammation gingivale chez les sujets à faible niveau d'hygiène, et pour eux, l'effet du tabac pourrait être double, puisqu'il pourrait agir de façon directe sur le milieu buccal en favorisant l'adhérence de la plaque selon un mécanisme inconnu, et/ou de manière indirecte par induction sur le système immunitaire en déprimant partiellement les PMN. Bergstrom et Preber,1986(19) ont expliqué cette augmentation par les propriétés vasoconstrictrices de la nicotine au niveau des vaisseaux et par conséquence une diminution du flux sanguin au niveau gingival.
Tabac et flore microbienne
Plusieurs études cliniques et épidémiologiques ont montré que les fumeurs ont plus de plaque et de tartre que les non fumeurs (Feldman et coll. 1983(5) ; Ismail et coll, 1983(4) ; Mac Gregor et Ruggy-Gunn, 1984(25)). Il semble que le tabac n'a pas un rôle majeur sur la flore bactérienne (Stoltenberg et coll,1993(27) ; Preber et coll. 1995(28)). Et il paraît probable que le tabac influence la réponse de l'hôte bien que d'autres études plus récentes ont montré d'après les analyses microbiologiques une augmentation significative du taux de bactéroïdes chez les fumeurs (Zambow et coll. 1996)(29). Cependant, aucune étude, jusqu'à présent n'a montré la présence de bactéries spécifiques associées au tabagisme pouvant favoriser l'établissement d'une flore microbienne plus virulente (Kenny et coll. 1975(15).
Des études in vitro ont montré que les bactéries sont sélectivement affectées par le tabac et que le passage d'aérobies aux anaérobies est possible. Néanmoins, le tabac peut entraîner une diminution du potentiel d'oxydo-réduction, qui peut provoquer une augmentation des bactéries anaérobies. Jaoui et Ouhayoun. en 1999(30) ont montré que la prévalence du Porphyromonas gingivalis et Actinobacillus actinomycetemcomitans est équivalente chez les fumeurs et les non fumeurs.
Tabac et maladies parodontales
L'influence du tabagisme en parodontie a été énormément étudiée, et les travaux les plus récents ont confirmé que le tabac inhalé constitue un facteur de risque majeur de la maladie parodontale (Bergstrom et Preber. 1994(2) ; Salvi et coll. 1997(3)) et que ce risque d'atteinte est 2 à 14 fois plus important qu'en l'absence de tabagisme (Grossi et coll.1994(8)).
Tabac et gingivite :
Les travaux de Pindborg, 1947(31) ont été probablement les premiers à étudier de manière scientifique l'effet du tabac sur la santé parodontale, grâce en particulier à des observations incluant plusieurs conclusions. Ainsi, le fait de fumer a rapidement été reconnu comme une des causes de gingivites aiguës chez des fumeurs et souvent de grands fumeurs (Lundwick et Massler. 1952(32) ; Giddow et coll. 1964(33) ; Kardachi et Clarke. 1974(34) ; Walter et Shields. 1977(35)). Des études plus récentes (Melnick et coll.1988(36)) ont confirmé le rôle étiologique du tabagisme dans la gingivite ulcéro-nécrosante aigûe (GUNA) avec un risque de 2 à 3 fois plus par rapport aux non fumeurs, et récemment, une relation équivalente a été démontrée entre les lésions associées à la GUNA chez les patients infectés par le virus VIH (Swango et coll. 1991(37)).
Pour la gingivite chronique, les résultats sont moins homogènes, surtout chez les patients jeunes. Certains auteurs ont montré peu ou pas de différence d'inflammation gingivale entre les fumeurs et les non fumeurs (Ainamo 1971(38); Feldman et coll. 1983(5) ; Bergstrom, 1989(6)). Par contre, d'autres auteurs ont rapporté que l'inflammation gingivale est très marquée chez les fumeurs (Preber et coll. 1980(26) ; Preber et Bergstrom. 1986(39)), et que cette augmentation de l'inflammation est expliquée par une quantité de plaque assez importante associée essentiellement à une mauvaise hygiène (Mac Gregor et Ruggy-Gunn. 1984(25) ; Mac Gregor 1984(40)).
Tabac et parodontite :
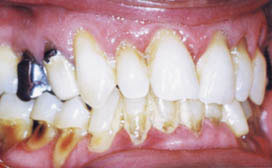
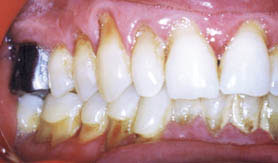
Il a été démontré que le tabagisme exerce à la fois des effets systémiques et locaux. Les fumeurs atteints de parodontite ont moins de saignement gingival que les non fumeurs avec le même niveau d'hygiène (Preber et Bergstrom, 1985(41)). Feldman et coll, 1983(5) ont montré que la fumée entrainerait la présence de poches parodontales et une perte osseuse augmentée. De plus, les fumeurs présentent moins de plaque , mais plus de tartre par rapport aux non fumeurs.
Actuellement, tous les auteurs s'accordent et suggèrent que le tabac est un facteur de risque majeur, et que les fumeurs ont une alvéolyse importante, des poches parodontales profondes et une perte d'attache plus sévère (Haber et coll. 1993(1) ; Grossi et coll. 1994(8) ; Linden et Mullally. 1994(20) ; Mullally et Linden. 1996(42) ; Zambow et coll. 1996(29)). Swango et coll,1991(37) ont montré que le tabac exerçait un effet significatif sur l'étendue de la bande érythémateuse gingivale typique des malades infectés par le VIH, les fumeurs présentant ainsi 2 fois plus de papilles nécrosées.
Tabac et atteinte de la furcation :
Plusieurs études épidémiologiques ont montré (Martinez-Camet et coll., 1995(43)) que chez des patients à très haut niveau d'hygiène, l'atteinte de la furcation, la mobilité dentaire et la résorption de l'os alvéolaire apparaissent plus marquées chez les fumeurs par rapport aux non fumeurs. Cette situation s'aggravant avec l'ancienneté de l'habitude. D'autres études (Mullally et Linden. 1996)(42) ont montré que dans le groupe des fumeurs, 86% des malades présentent des signes d'atteinte de la furcation par rapport à 72% dans le groupe non fumeurs. Le nombre de malades atteints de la furcation est plus élevé chez les fumeurs 1,94% que chez les non fumeurs 0,94%, donc le fait de fumer des cigarettes est associé avec une manifestation plus marquée de l'atteinte de la furcation chez les patients présentant une parodontite.
Tabac et sévérité de la maladie parodontale :
La corrélation entre le tabagisme et la sévérité parodontale a été longuement étudiée et toutes les études confirment que le tabac augmente la sévérité de la maladie parodontale, et cela est d'autant plus marqué que la consommation du tabac est importante. Preber et Bergstrom, 1986(39) ont montré qu'à hygiène égale, la maladie parodontale n'est pas plus grave chez les fumeurs comparés aux non fumeurs, les poches parodontales ne sont pas plus profondes sauf du côté palatin. Récemment, Martinez-Camet et coll, 1995(43) ont évalué l'influence du tabac inhalé sur la sévérité de la maladie parodontale. Il a été montré que l'effet du tabac sur la parodontite ne présente pas d'association avec l'âge et le sexe (Haber et coll. 1993(1) ; Bergstrom et Preber. 1994(2), Preber et coll. 1995(28)).
Ces mêmes auteurs ont montré que les maladies parodontales étaient plus sévères chez les fumeurs. Dans une étude longitudinale des facteurs pronostiques, chez les patients atteints de parodontite établie, Machtei et coll.1997(44) ont démontré que les fumeurs présentaient une perte osseuse et une perte d'attache plus marquée que les non fumeurs.
 |
 |
CONCLUSION
Aucune étude épidémiologique ou clinique n'a pu démontrer le rôle étiologique du tabac dans la maladie parodontale. Cependant, il demeure un facteur de risque majeur des maladies parodontales et un facteur aggravant surtout si la consommation du tabac est importante et l'habitude est ancienne.
Sur le plan systémique, la consommation de tabac entraîne des interactions avec le système immunitaire, en général, dans le sens d'une dépression de son fonctionnement. Cet effet indirect s'ajoutant à l'action des radicaux libres de la fumée et de la nicotine, contribue à rendre le tissu gingival plus susceptible à l'agression bactérienne. Le tabac intervient aussi sur le comportement cellulaire, en interférant avec ses propriétés biologiques fondamentales.
En conséquence, la consommation du tabac intervient sur la prévalence et la sévérité des parodontites de l'adulte, ainsi que sur les parodontites réfractaires et la gingivite ulcéro-nécrotique.
BIBLIOGRAPHIE
1-Haber J., Wattles J., Cromby M., Mandell R., Kent RL. - Evidence for cigarette smoking as a major risk factor peridontitis. J. Peridontol., 1993, 84 : 16-23.
2- Bergstrome J., Preber H., Tobaco use as a risk factor. J. Periodontol., 1994, 65 : 545-550.
3- Salvi GE., Lawrence HP., Beck JD. - Influence of risk factor on the pathogenesis of peridontitis. periodontology 2000, 1997 : 14 : 173-202.
4- Ismail AI., Brut BA., Eklund SA. - Epidemiologic patterns of smoking and peridontal disease in the United States. J. Am. Dent. Assoc., 1983, 106 : 617-623.
5- Feldman RS., Bravacos J.S., Rose C.L., Association between smoking different tobacco produits and peridontal disease indexes. J. Periodontol., 1983, 64 : 487-497.
6- Bergstrom J. - Cigarette smoking as risk factor in chronic peridontal disease. Community Dent. Oral. Epidemiol., 1989, 17 : 245-247.
7- Bergstrome J., Eliassow S., Preber H. - Cigarette smoking and periodontal bone, J. Periodentol., 1991, 62 : 242-246.
8- Grossi SG., Genco RJ., Maditei EE. - Assessement of risk for periodontal disease II. Risk indications for attachment loss. J.
Periodontol., 1994, 65 : 260-267.
9- Mac Farlane CD., Herz Berg MC., Wolff LF., Hardie VA., Refract may periodontitis associated with abdominal polymorphonuclear leucocyte phagocytosis and cigarette smoking. J. Periodontal, 1992, 63 : 908-913.
10- Bergstrom J., Blomlof L., Tobacco smoking major risk factor associated with refractory periodontal disease. J. Dent. Res. 1992, 71 : 297 (Abs 1530).
11- Johnson BD., Engel D. Acute necrotizing ulcerative gingivitis. A review of diagnosis, etiology and treatment. J. Periodontol., 1986, 57 : 141-150.
12- Haber J., Kent R. L. - Cigarette smoking in a periodontal practive. J. Peridontal., 1992, 63 : 100-106.
13- Lagrue J., Composants de la fumée de tabac et leurs effets. Rev. Prat., 1992, 42 (1) : 127-130.
14- Mac Gregor, Edgar W.N. - Calcium and phosphate concentration and precipitation formation in whole sliva from smokers and non-smokers. J. peridontol., Resea, 1986, 21 : 429-483.
15- Eidrel B., Sharick HA., Tobacco smoke toxicity, loss of human oral leukocyte function and glucid cell metabolism. Science, 1969, 166 : 1424-1428.
16- Kenny EB., Saxe SR, Bowles RD. - The effect of cigarette smoking on aneorobiosis in the oral cavity. J. Perodontol., 1975, 46 : 82-88.
17- Gerrand JW., Herwer DC., Mink J., Dosman JA. - Immunoglobulin levels in smokers and now smokers. Ann. Allergy, 1980, 44 : 261.
18- Johnson JD., Hohchens DP., Fisher GU. - Effects of manstream and envirennemental tobacco smoke on the immune system in animals and human. A review. Critic. Rev. Toxicology, 1990, 20 : 359.
19- Bergstrome J., Preber H. - The influence of cigarette smoking on the developpement of experimental gingivitis. J. Periodont. Res., 1986, 21 : 668-676.
20- Linden BJ., Mullally BH. - Cigarette smoking and periodontol destruction in young adult. J. Periodontol., 1994, 65 : 718-723.
21- Sheiham A. - Periodontal disease and clearliness in tobacco smokers. J. Perdiodontol, 1971, 42 : 259-263.
22- Modeer T., Lavstedt S., Ahlund C. - Relation between tobacco consumption an oral health in sweden schollchildren. Acta Odontol. Scand., 1980, 38 : 223-227.
23- Bastiaan RJ., Waite IM. - Effects of tobacco smoking on plaque development and gingivitis. J. Periodontol., 1978, 49 : 480-482.
24- Swenson HM. - The effects of tobacco smoking on periodontol tissue of 15 years old school children. J. Pariodont. Res., 1973, 8 : 273-283.
25- Mac Gregor IDM., Ruggy-Gunn AJ. - Unistructed touthbrushing behaviour in young adults in relation to cigarette smoking in Newcrothe. Comm. Dent. Oral. Eppidemiol., 1984, 12 : 358-360.
26- Preber H. Kant T., Bergstrome J. - Cigarette smoking, oral hygiene and periodontol health in swedish army conscripts. J. Clin. Periodontol., 1980, 7 : 106-113.
27- Stoltenberg JL., Osborne JB., Pihlstrom BL., Fisher GE. - Association between cigarette smoking, bacterial pathogens and periodontal status. J. Periodontol., 1993, 64 : 1225-1230.
28- Preber H., Lunder L., Bergstrome J., Periodontol healing and periopathogenic microflore in smokers and now-smokers. J. Clin. Periodontol., 1995, 22 : 946-952.
29- Zambow JD., Grossi SG., Genco RJ. - Cigarette smoking increases the risk fo subgingival infection with periodontal pathogens. J. Periodontol., 1996, 67 : 1050-1054.
30- Jaoui L., Ouhayoun JP. - Evaluation clinique et microbiologique de patients fumeurs atteints de maladies parodontales. Etude rétrospective. J. Paro., 1999, 18 (3) : 265- 276.
31- Pindborg JJ. - Tobacco and gingivitis, statistical examinations of the significance of tobacco in the developpment of ulcero-membranous gingivitis and in the formation of calculus. J. Dent. Res., 1947, 26 : 261-264.
32- Lundwik W., Massler M. - Relation of dental carries experience and gingivitis to cigarette smoking in males 17 to 21 years old. J. Dent. Res., 1952, 31 : 319-322.
33- Giddow DB., Zakin SJ., Goldhaber P. - Acute necrotizing ulcerative gingivitis in college students. J. Int. Dent. Asso., 1964, 68 : 381-386.
34- Kardachi BJR., Clarke MJ., Aetiology of acute necrotizing ulcerative gingivitis : a hypothetical exploration. J. Peridontol., 1974, 45 : 830-832.
35.Walter CPT., Shields D.- Acute necrotizing ulcerative gingivitis. A study of some of the contributing factors and there validity in an army population. J. Periodontol., 1977, 48 : 346-349.
36- Melncik SL., Roseman J.M., Engel D., Cogen RB. - Epidemiologic reviews, reviews, 1988, 101 : 191-211.
37- Swango PA., Kleinman DV., Kongelman JL. - HIV and periodontal health : a study of military personnel with HIV. J. Am. Dent. Ass., 1991, 122 : 49-54.
38- Ainamo J. - The seeming effect of tobacco consumption on the occurence of periodontal disease and dental caries. Snow Hamm Laak Toimt, 1971, 67 : 87-94.
39- Preber H., Bergstrom J. - Cigarette smoking in patients refered for periodontal treatment. Scand. J. Dental. Res., 1986,94 : 102-108.
40- Mac Gregor IDM - Truth brushing efficiency in smokers and non smokers. J. Clin. Periodontol., 1984, 11 : 313-320.
41- Preber H. Bergstrom J., Occurrence of gingival bleeding in smoker and non smoker patients. Acta Odontol. Scand., 1985, 43 : 315-320.
42- Mullally BH., Linden GJ. - Molar furcation involvment associated with cigarette smoking in peridontal referrals. J. Clin. Periodontol., 1996, 23 : 258-661.
43- Martinez-Camet P., Lorea A., Magan R. - Smoking and periodontal disease severity. J. Clin. Peridontol., 1995, 22 : 743-749.
44- Machtei EE., Dunford R., Hansmann E., Grossi SG., Genco RJ. - Longitudinal study of prognostic factors in established periodontitis patients. J. Clin. Periodontol., 1997, 24 : 102-109.








