B. ABBASSI, M. SIDQUI, N. AUSSALAH, K. AMINE, J. KISSA
Service de Parodontologie
Faculté de Médecine Dentaire de Casablanca
Université Hassan II
RÉSUMÉ
Le diabète est un syndrome caractérisé par une élévation du glucose sanguin. Il touche également la fonction des neutrophiles et des macrophages, la structure des vaisseaux sanguins et le métabolisme du collagène d’où son impact sur la maladie parodontale et sa considération comme facteur de risque de la maladie parodontale.
Les manifestations buccales du diabète comprennent, en dehors des manifestations parodontales, une xérostomie, une sensation de brûlure de la langue, une dysgueusie et l’augmentation de la tendance à contracter des infections à Candida.
Il semble que l’inflammation gingivale et le saignement, ainsi que les poches parodontales, soient plus fréquents chez ceux dont le diabète n’est pas compensé.
Par ailleurs, la mauvaise hygiène associée à un état parodontal altéré risque, chez des diabétiques non compensés, d’aggraver ce syndrome. Une attitude préventive et curative s’impose, sur le plan parodontal impliquant une conduite à tenir précise.
Notre travail se propose de définir l’interrelation entre diabète et état parodontal ainsi que la conduite à tenir préventive et curative qui en découle lors de la prise en charge des patients diabétiques pour des soins parodontaux.
Mots-clés : Diabète, maladie parodontale.
Le diabète est un syndrome métabolique caractérisé par une élévation du taux de glucose sanguin. Il se divise en deux principales entités :
- Le diabète insulino-dépendant : l’atteinte survient avant l’âge de 20ans ayant pour complications des microangiopathies et des macroangiopathies. Le traitement consiste en un apport d’insuline par voie externe,
- Le diabète non insulino-dépendant : l’atteinte survient au-delà de 40 ans ayant pour complications des microangiopathies et des macroangiopathies. Le traitement consiste en un régime alimentaire, associé à des hyperglycémiants (Hage et Davarpanah, 1998) (1).
Le diabète figure parmi les facteurs de risque de la maladie parodontale. Néanmoins, l’interrelation entre les deux (diabète et maladie parodontale) reste un sujet de multiples controverses.
RÉPERCUSSIONS DU DIABÈTE SUR LA CAVITÉ BUCCALE
Le diabète est à l’origine de perturbations multiples ayant des répercussions sur le milieu buccal en général et sur le parodonte en particulier.
Au niveau tissulaire :
Le parodonte est constitué par l’ensemble des tissus entourant la dent. Il comprend la gencive, l’os alvéolaire, le ligament alvéolo-dentaire et le cément. Ces tissus sont constitués par des cellules et par une matrice extra-cellulaire, constituée, essentiellement par des fibres de collagène (Bercy et Tenenbaum, 1998) (2).
Le diabète engendre une augmentation de l’activité collagénolytique destructrice des tissus gingivaux et du ligament parodontal, diminue la synthèse de collagène et entraîne une baisse de la synthèse des composantes de la matrice osseuse (Salvi et coll., 1997) (3).
Ainsi, ce syndrome ralentit le processus de cicatrisation et accélère celui de la destruction au niveau parodontal (Salvi et coll., 1997) (3).
Au niveau des fluides buccaux :
Salive :
Il est observé de manière fréquente, une hyposialie par diminution du fluide salivaire, accompagnée d’une augmentation de la viscosité, la salive devient collante et mousseuse. Le PH salivaire tend vers l’acidité, de plus si la glycosurie est élevée, on observe parallèlement une glycosialie et une plus forte concentration en ions Ca++ (Arnult, 1989) (4).
En 1996, Guven et coll. (5) ont mesuré l’activité de la peroxydase salivaire (un facteur de défense anti-bactérien) chez des patients diabétiques insulino-dépendants ayant une tendance à la parodontite. Les résultats ont montré que l’activité moyenne de la péroxydase salivaire est significativement plus élevée, accompagnée de scores augmentés des indices cliniques chez les diabétiques en comparaison avec les patients sains. Ils ont conclu que l’utilisation du test de péroxydase salivaire peut être considéré comme moyen simple et pratique dans l’évaluation de la tendance à la parodontite chez les patients diabétiques.
Fluide gingival :
La collagénase est considérée comme l’initiateur clé de la dégradation du collagène lors du processus de destruction parodontale (Sorsa 1990 in A). Les fibroblastes, les cellules épithéliales, les neutrophiles, et les macrophages sont des sources possibles de cette enzyme (Sorsa et coll. , 1992, Igman et coll., 1994) (6,7).
En 1992, Sorsa et coll. (6) ont mené une étude dont le but est de caractériser les origines cellulaires, l’activation et l’inhibition de la collagénase chez des patients insulino-dépendants et de faire la comparaison avec la collagénase du fluide gingival chez des patients atteints de parodontite juvénile localisée (PJL). Ainsi la collagénase des patients diabétiques dérivait des neutrophiles tandis que l’enzyme trouvée dans la PJL provenait principalement des fibroblastes.
Par ailleurs, le traitement à la tétracycline, selon cette étude, peut être considéré comme un adjuvant efficace visant à maîtriser la destruction parodontale chez les patients diabétiques. Cependant, dans la PJL, les propriétés anti-collagènase des tétracyclines peuvent avoir moins d’importance pour maîtriser la destruction parodontale, en raison de la résistance à la tétracycline de la collagénase des fibroblastes.
Au niveau de la flore buccale :
Mashino et coll. (1983 in1) ont montré que les capnocytophages étaient prédominants dans la majorité des poches parodontales de jeunes diabétiques insulino-dépendants. Actinobacillus actinomycetemcomitens a été également retrouvé en quantité importante dans cette étude.
Plusieurs autres études n’ont pu confirmer ces résultats, et d’une manière générale, la flore sous gingivale est similaire à celle rencontrée dans la parodontite de l’adulte (Zambon et coll. 1988 in 3), (Sastrowijoto et coll. 1989 in1), aussi bien chez les patients insulino-dépendants que ceux non insulino-dépendants.
Au niveau du système immunitaire :
L’augmentation de la susceptibilité du diabétique à la maladie parodontale a été associée à une altération des fonctions des leucocytes (Salvi et coll., 1997) (3).
Un phénotype monocytaire anormal expliquerait l’importance des destructions parodontales chez certains diabétiques. Ce même phénotype est trouvé chez des individus atteints de parodontite à progression rapide ou parodontite réfractaire (Page et coll. 1997 in 1).
Au niveau vasculaire :
L’exposition prolongée des vaisseaux à l’hyperglycémie, induit une augmentation de la rigidité de ces vaisseaux avec réduction du diamètre vasculaire.
Ces perturbations ont pour conséquences d’empêcher la diffusion de facteurs de l’immunité, de l’oxygène au niveau des tissus gingivaux et du ligament parodontal (Zachariasen 1992 in 1).
ÉTIOPATHOGÉNIE DE LA MALADIE PARODONTALE CHEZ LE PATIENT DIABÉTIQUE
Modifications vasculaires :
L’exposition prolongée à l’hyperglycémie est le facteur étiologique primaire à l’origine des modifications vasculaires survenues lors du diabète. En effet, l’élévation chronique du niveau de glucose sanguin engendre la formation de produits finaux de glycation. Ces derniers correspondent à une classe hétérogène de protéines glycosilées et de lipides retrouvés au niveau du plasma et des tissus vasculaires.
Les principaux changements structuraux consistent en une glycation du collagène de type 1 situé au niveau de la membrane basale de la paroi vasculaire, ce qui va mener à l’augmentation de la rigidité des vaisseaux sanguins et donc l’altération du passage des leucocytes, de la diffusion d’oxygène et de déchets métaboliques. Ainsi, un stress oxydatif s’installe avec péroxydation lipidique et sécrétion de cytokines pro-inflammatoires favorisant la destruction parodontale (Salvi et coll., 1997) (3) (Fig.1).
Modifications de la réponse de l’hôte :
L’augmentation de la susceptibilité à la maladie parodontale est associée à une altération des fonctions des leucocytes : un défaut au niveau du chimiotactisme, de l’adhérence et la phagocytose des leucocytes est à l’origine d’une dimunition de la résistance de l’hôte (Cutler et coll. 1991in1, 3).
Bissada et coll. (1982 in 3) ont démontré que chez les patients diabétiques atteints d’une maladie parodontale sévère, la réponse chimiotactique est diminuée en comparaison avec les patients sains atteints d’une maladie parodontale sévère.
Cutler et coll. (1991 in 3) ont mis en évidence un nombre de polymorphonucléaires (PMN) diminué au niveau sanguin chez les patients diabétiques avec une altération des fonctions de phagocytose et destruction dirigées contre Porphyromonas gingivalis.
Salvi et coll. en 1997 ont montré que la prostaglandine E2 est considérée comme un inhibiteur des lymphocytes producteurs d’anti-corps.
Par ailleurs, la fonction des PMN est sous l’influence du taux de lipides sanguins : la perturbation du métabolisme lipidique due au diabète et l’augmentation des lipides sanguins altèrent significativement la fonction de phagocytose des PMN.
Ainsi, on peut conclure que le syndrome du diabète a comme conséquence une dys-régulation métabolique pouvant aggraver la sévérité de la maladie parodontale (Salvi et coll., 1997) (3).
 |
 |
 |
|
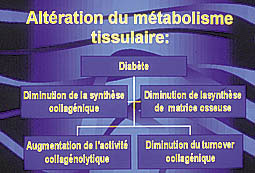
Altération du métabolisme tissulaire :
Le collagène de type 1 représente le composant prédominant de la matrice extra-cellulaire, au niveau du tissu gingival, du ligament parodontal, et de l’os alvéolaire.
Le dysfonctionnement métabolique induit par le diabète est associé à une anomalie du turnover du collagène. En effet, l’hyperglycémie engendre une diminution de l’activité mitotique des fibroblastes avec l’augmentation de l’activité de la collagénase (Golub, 1978)(3)
Ainsi, la synthèse du collagène par les fibroblastes du tissu gingival et du ligament parodontal et la production des composants de la matrice osseuse se retrouve à son tour perturbée.
Ces altérations auront pour conséquence une perturbation de la cicatrisation parodontale (rôle primordial du collagène pendant cette phase), ainsi qu’une aggravation de la sévérité de la maladie parodontale (Fig.2).
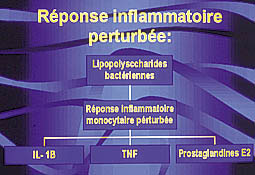
Perturbation de la réponse inflammatoire :
Une inflammation excessive des monocytes aux lipopolysaccharides bactériennes est relevée chez les patients diabétiques. Cette réponse se manifeste par une sécrétion amplifiée des médiateurs pro-inflammatoires : l’interleukine 1B, la prostaglandine E2 et le TNF (factor necrosis tumor), responsables d’une aggravation de la destruction parodontale (2).
En 1998, Doxey et coll., lors d’une étude portant sur les rats, ont démontré un taux gingival élevé des IL-1B sécrétées par les macrophages, ceci en présence de diabète et de parodontite (8).
Setein et coll. (1997) (9), lors d’une étude menée auprès de patients diabétiques ont montré un taux élevé d’IL-10, un pourcentage élevé de lymphocytes B(CD4), et des sécrétions anti-collagéniques cellulaires excessives (9) (Fig.3).
CONCLUSION
Bien que le mécanisme par lequel le diabète augmente le risque de la parodontite reste incertain et controversé, il a été clairement défini comme un facteur de risque majeur prédisposant à la maladie parodontale. En effet, un diabétique a 2 à 3 fois plus de risque de développer une parodontite par rapport à un non diabétique. De même selon une méta-analyse du diabète comme facteur de risque de la maladie parodontale, issue de plusieurs études, un coefficient de corrélation de 0,16 à 0,22 a été trouvé (10).
BIBLIOGRAPHIE
1 - Hage G., Davarpanah M. Diabète et état parodontal : Données actuelles. J. Parodontol, 1998 ; 17 : 447- 452.
2 - Bercy P., Tenenbaum H. Parodontologie du diagnostic à la pratique. DeBeock et Lacier, 1996 :14-18.
3 - Salvi G.E. , Lawrence H.P., Offenbacher S. Influence of risk factors on the pathogenesis of periodontitis. Periodontol. 2000, vol. 14, 1997, 173-201.
4 - Arnult N. Diabète et thérapeutiques buccales. Rev. Odonto. Stomatol., 1989, Tome18, n°2 : 161-164.
5 - Guven Y., Satman I., Dinççag N., Alptekin S. Salivary peroxydase activity in whole saliva of patients whith insulin-dependent (type 1) diabetes millitus. J. Clin. Periodontol 1996 ; 23 : 879- 881.
6 - Sorsa T., IngmanT., Suomalainen K., Halinen S., Saari H., Konttinen YT., Uitto V-j, Golub LM. Cellular source and tetracycline-inhibition of gingival crevicular fluid collagenase of patients with labile diabetes. J. Clin. Periodontol 1992 ;19 : 146-149.
7 - Igman T., Sorsa T., Lindy O., Koski H, Konttinen YT. Multiple forms of gelatinase type 4 collagenase in saliva and gingival crevicular fluid of periodontitis patients. J. Clin. Periodontol. 1994 ; 21 : 26-31.
8 - Doxey D.L., Cutler C.W. Diabetes prevents periodontitis-induced increases in gingival platelet derived growth factor-B and interleukin 1- Beta in a rat model. J. Periodontol. 1998 ; 69 : 113-119.
9 - Stein SH., Hart TE., Hoffman WH., Hendris CL., Guske CJ., Watson SC., Interlukin-10 promotes anti-collagen antibody production in type 1 diabetic peripheral B lymphocytes. J. Periodontol. Res. 1997 ; 32 : 189-195.
10 - Pappapanou P.N. Periodontol diseases : epidemiology. Ann Periodontol 1996 ;1 :1-36.








