J. HAMAMA*, A. ABOUCHADI**, M. NASSIH***.
* 5ème Hôpital militaire - GUELMIM
** Hôpital militaire d’instruction Mohammed V - Rabat
*** Hôpital militaire Moulay Ismail - Meknès
RÉSUMÉ
Introduction :
L’améloblastome est une tumeur odontogène bénigne mais localement invasive et potentiellement récidivante. L’objectif de notre travail est de démontrer l’efficacité du traitement radical à réduire ce risque de récidive.
Matériel et méthodes :
Il s’agit d’une étude rétrospective sur 14 patients opérés pour améloblastome mandibulaire dans le service entre 2001 et 2008. Une fiche de recueil a exploité plusieurs données notamment le type de chirurgie.
Résultats :
Il existait une nette prédominance féminine (71,4 %).%). L’âge moyen était de 30 ans. Dans notre étude. L’aspect radiologique kystique d’améloblastome était le plus vu dans 61,5% des cas. Le traitement conservateur en 1ère intention a été réalisé chez 13 patients dont 61% ont eu une récidive.
Discussion :
Notre étude concorde avec les données de la littérature et confirme la supériorité de la chirurgie radicale face à la problématique du potentiel récidivant de l’améloblsatome.
Mots-Clés : améloblastome, mandibule, chirurgie conservatrice, chirurgie radicale, récidive.
INTRODUCTION
L’améloblastome est une tumeur odontogène bénigne mais localement invasive et potentiellement récidivante, constituant alors une problématique pour tout chirurgien maxillo-facial. A travers une étude rétrospective nous analysons la qualité de notre prise en charge thérapeutique.
MATERIEL ET MÉTHODES
Il s’agissait d’une étude rétrospective sur 14 patients opérés pour améloblastome mandibulaire dans le service entre 2001 et 2008. Une fiche de recueil des données a porté sur l’âge, le sexe, les signes révélateurs, la localisation tumorale, les aspects radiologiques, le type de chirurgie, l’histologie et l’évolution.
La localisation maxillaire a été exclue de cette étude rétrospective.
RÉSULTATS
L’étude a porté sur 14 patients, quatre hommes (28,6%) et dix femmes (71,4 %). Leur âge moyen était de 39 ans avec des extrêmes de 20 ans à 65 ans. La symptomatologie amenant à consulter était la tuméfaction dans 11 cas (78%) ,la douleur dans 3 cas (22%).
| Localisation | Fréquence |
| Synphyse | 15,4% |
| Branche horizontale | 15,4% |
| Angle | 7,7% |
| Branche montante | 23,1% |
| Étendue | 28,5% |
Tableau 1 : localisation d’améloblastome au niveau de la mandibule.
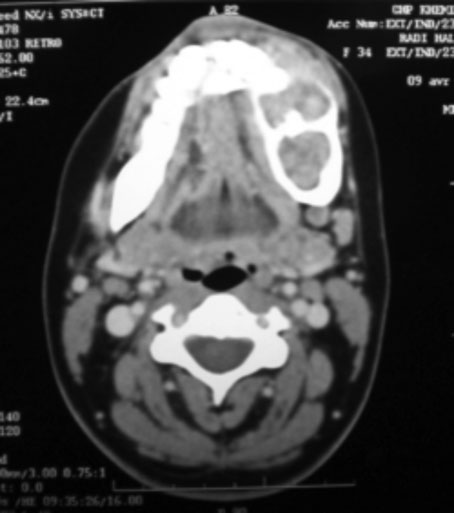
La localisation tumorale à la mandibule se répartit comme reporté sur le tableau1. L’aspect radiologique était kystique dans 61,5% des cas ; uniloculaire dans 15,4% (Fig.1) des cas et multiloculaire 23,1% cas (Fig.2).
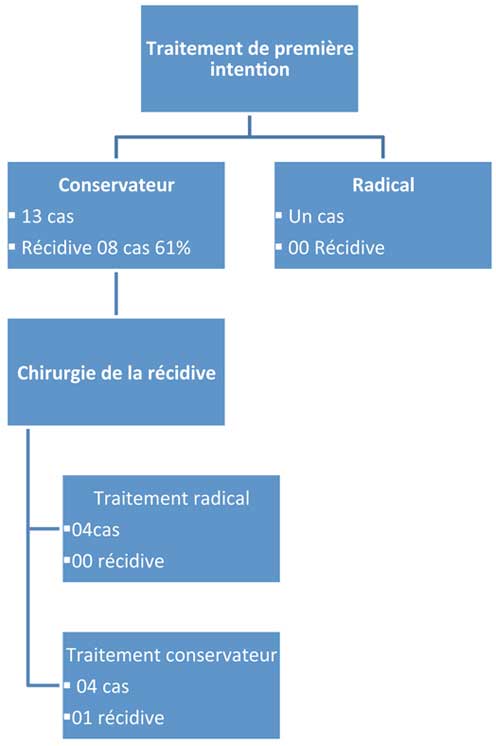
Le traitement conservateur en 1ère intention a été réalisé chez 13 patients, consistant en une énucléation simple ou énucléation associée à un curetage.
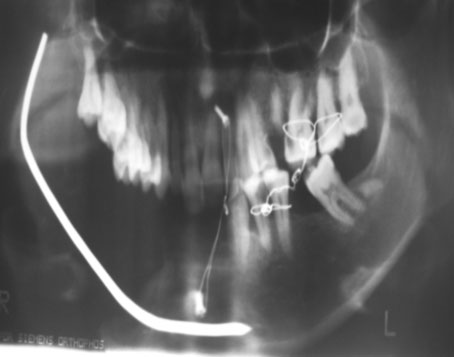
Une patiente a bénéficié d’un traitement radical d’emblée en 1ère intention : une interruptrice terminale suivie d’une reconstruction par une endoprothèse (Fig.3).
|
Fig.1 : TDM en 3D montrant l’aspect uniloculaire
|
|
 |
|
 |
L’histologie a confirmé le diagnostic d’améloblatome dans tous les cas. Le type histologique précis a été rapporté dans cinq cas (kystique dans quatre cas, folliculaire dans un cas).
Tous nos patients ont été suivis régulièrement avec un recul allant de un an jusqu’à huit ans.
08 patients sur 13 qui ont bénéficié d’un traitement conservateur en 1ère intention, ont eu une récidive au bout de une année soit 61% de récidive pour un traitement conservateur.
Sur la même période nous n’avons constaté aucune récidive concernant la patiente qui a bénéficié d’un traitement radical d’emblée.
La prise en charge de la récidive a été réalisée ainsi :
• 04 patients ont bénéficié d’un traitement radical, la reconstruction a fait appel au greffon iliaque dans 02 cas, au transplant osseux libre microvascularisé TOVL du péroné dans un cas (Fig 4 & 5), plaque d’ostéosynthèse dans un cas. Nous déplorons un décès dans un cas survenu dans les suites de réanimation. Aucune récidive n’a été notée chez les autres patients.
• 04 patients ont eu un traitement conservateur, nous avons noté une récidive dans un cas, qui a nécessité un traitement radical en seconde intention.
|
Fig.4 : Aspect peropératoire du lambeau de péroné microanastomosé
|
|
| Fig.5 : Ostéosynthèse du TOVL par maxiplaque |
DISCUSSION
L’améloblastome est un néoplasme épithélial constitué de cellules dentoformatrices.
Il est défini par l’OMS en 1972 comme étant : .
Elle prend naissance à partir de l’épithélium odontogène et se développe au sein d’un stroma fibreux, sans reproduire dans son développement de tissus calcifiés tels que l’émail, la dentine ou autres matériaux.
Les premières descriptions dans la littérature datent du XVII siècle, mais c’est Malassez, en 1885, qui en attribue l’origine à l’organe adamantin. Depuis, l’améloblastome continue d’interpeller les anatomopathologistes par la variété de ses types histologiques et les thérapeutes par l’aspect clinique et évolutif trompeur de certaines formes qui soulèvent des problèmes de diagnostic et de traitement délicats.
Les améloblastomes sont rares et ne représentent que 1% de toutes les tumeurs des maxillaires et environ 11% de l’ensemble des tumeurs odontogènes.
L’améloblastome atteint la mandibule dans 80% des cas.
La chirurgie demeure l’unique moyen thérapeutique curatif, deux méthodes d’exérèse existent : soit conservatrice, soit radicale.
Le choix d’une méthode ou de l’autre est difficile car la tendance à la récidive des améloblastomes influence beaucoup l’attitude thérapeutique et la question à la quelle se trouve toujours confronté le chirurgien est : faut-il adopter une attitude (1) conservatrice ou radicale ?
Cette question a fait l’objet de nombreuses études et tous les auteurs se sont acharnés pour y apporter la bonne réponse.
Nakamura a comparé les résultats des deux approches thérapeutiques sur une série de 78 cas avec un suivi de 5 ans (2), et a relevé :
- 7 % de récidive (3/42) après chirurgie radicale ;
- 33,3 % (12/36) après chirurgie conservatrice.
Il a noté une tendance élevée à la récidive des lésions multi kystiques, du type histologique folliculaire et plexiforme.
Hong a démontré que les formes uni kystiques étaient de meilleur pronostic après un traitement conservateur (3): 11 récidives sur 71 cas (15,5 %).
Des publications récentes semblent pencher pour un traitement radical d’emblée. En effet, une revue de la littérature démontre l’inefficacité du traitement conservateur (4). Il insiste sur le fait que pour guérir les patients en utilisant une approche scientifique, une résection avec des limites histologiques saines, est nécessaire. La comparaison des différents taux de récidive, montre des taux variant entre 36 et 100% après traitement conservateur, et entre 0 et 21% après traitement radical.
Selon Gardner 55 à 90%de ces tumeurs récidivent après énucléation simple (5).
Adrian sur une série de 30 cas, la chirurgie radicale était d’emblé en 1ère, aucune récidive n’a été déplorée sur un recul de 5 ans (6).
L’intérêt d’une biopsie pré opératoire qui confirmerait le diagnostic nous parait dérisoire devant des lésions bien limitées intra osseuses dont l’approche conservatrice est justifiée par la bénignité de la tumeur et l’observance future du patient aux consultations de contrôle ; quant aux lésions étendues nécessitant une chirurgie radicale, là encore une confirmation histologique pré opératoire n’est pas indispensable devant des images radiologiques évocatrices. Cette attitude rejoint les conclusions de Hong qui a démontré l’absence d’influence du résultat de la biopsie pré-opératoire sur le pronostic de la tumeur (3); d’autant qu’actuellement il n’y a pas d’unanimité sur le pronostic d’un type histologique par rapport à un autre.
Les résultats à long terme du traitement conservateur et radical sont très variables. Ce fait s’explique par les indications qui ne sont pas unanimes et surtout par le manque de standardisation des procédures chirurgicales.
Le pourcentage élevé de récidive après traitement conservateur peut être expliqué par l’indication inadaptée, par la conduite technique de ce traitement, plusieurs termes sont utilisés dans la littérature sans être bien expliqués, c’est le cas de l’énucléation, du curetage, qui peuvent impliquer ou pas une exérèse osseuse péri tumorale à minima à la fraise ou à la pince gouge (1).
Toutefois certains auteurs ont rapporté des résultats positifs sur des petites séries.
En effet Stephens, sur 12 cas traités après réalisation d’une fenêtre osseuse par énucléation suivie d’une résection osseuse à la fraise emportant 2 à 3 mm, n’a relaté aucune récidive durant un suivi moyen supérieur à 10 ans (7).
Bataineh, dans une série de 23 améloblastomes sans rupture corticale, a effectué un traitement conservateur, et n’a relevé aucune récidive sur un suivi moyen de 6,5 ans (8).
Le traitement radical peut prendre deux formes :
• Résection avec une marge de sécurité périphérique : résection en bloc ou mandibulectomie marginale avec des marges osseuses allant de 1 à 2 cm, selon Feinberg une marge osseuse saine de 1 à 1,5 cm est nécessaire pour diminuer le risque de récidive (9), c’est à travers une étude portant sur 82 améloblastomes, qu’il a montré une infiltration microscopique de 2 à 8 mm au-delà de l’image radiologique.
Un examen radiologique de la pièce opératoire peut donc être utile pour savoir si la résection est passée en zone saine.
• Résection segmentaire ou interruptrice : hémimandibulectomie avec une marge de sécurité périphérique et sans rupture de la continuité osseuse.
Hong, sur une série de 239 améloblastomes avec 305 interventions chirurgicales durant une période de 22 ans, a démontré qu’il n’y a pas de différence significative entre la résection interruptrice et la résection non interruptrice en matière de pronostic et de récidive (3).
Les tumeurs récidivées après résection initiale interruptrice et large sont sans doute à mettre sur le compte d’une effraction de la tumeur lors de l’exérèse menée à tort par voie extra périostée, ou par abord endobuccal exclusif.
Sur notre série, le traitement radical consistait à faire une chirurgie interruptrice en réséquant la tumeur avec une marge d’os sain de 1cm clinique et/ou radiologique. Alors, que le traitement conservateur consistait en une énucléation de la tumeur avec effondrement des cloisons, curetage de la cavité résiduelle emportant jusqu’à 5 mm d’os, associée ou non à un tamponnement à l’acide trichloracétique.
Notre série se caractérise par la prépondérance du traitement conservateur en 1ère intention soit 92% des cas, avec un taux élevé de récidive, confirmant alors les données de la littérature.
Ce constat ne devrait-il pas nous plier aux tendances actuelles d’être radical d’emblée.
Cela suppose une mise à niveau des opérateurs pour utiliser des lambeaux microchirurgicaux
La notion de récidive en matière d’améloblastome est considérée de manière abusive. Il n’y a pas de parallélisme entre la récidive et la gravité, comme c’est le cas dans les cancers osseux, par conséquent la récidive n’est pas synonyme d’échec chirurgical ni de mauvais pronostic tant que la nouvelle lésion est similaire ou même inférieure à la lésion initiale.
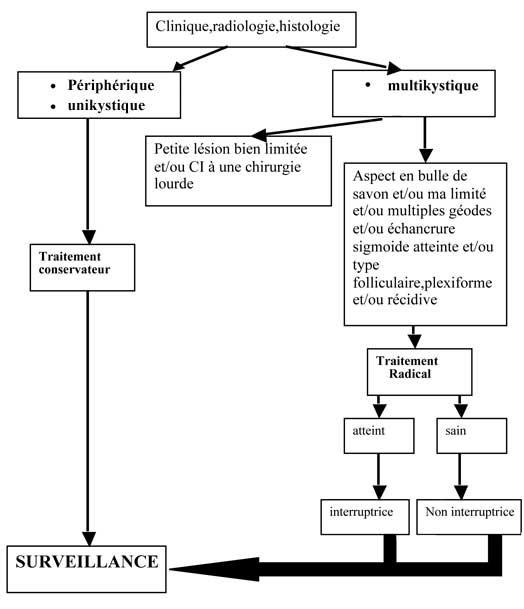
En matière d’améloblastome le choix thérapeutique ne peut être systématisé.
La décision thérapeutique devrait être guidée par la clinique, la radiologie et l’histologie. En effet, l’agressivité de la lésion dépend des caractéristiques suivantes :
• type compact ou polykystique,
• limites floues à la radiologie,
• types folliculaires et plexiformes à l’histologie.
|
|
Retrouver un de ces signes indique qu’il s’agit d’un améloblastome à haut pouvoir invasif.
Une résection mandibulaire devrait s’imposer en première intention lorsque la tumeur présente une configuration polygéodique, excluant toute possibilité d’énucléation complète vu la multiplicité des lésions.
Elle sera non interruptrice lorsque le bord basilaire est sain et interruptrice s’il est atteint.
Le nerf alvéolaire doit quant à lui être sacrifié s’il est atteint et doit être emporté avec la résection en bloc. Sa préservation est possible si son canal n’est pas atteint et si l’améloblastome ne présente pas les critères d’agressivité sus-cités.
 |
CONCLUSION
En matière d’améloblastome mandibulaire, la chirurgie radicale est le seul garant d’un bon pronostic, cela suppose une chirurgie réparatrice faisant appel à des transplants microanastomosés afin d’assurer une meilleure qualité de vie.
BIBLIOGRAPHIE
1- Kamal D., Kaba Harding B, El Khatib K, Nassih M, Goudot P, Rzin A, Jidal B.
Traitement de l’améloblastome mandibulaire : chirurgie radicale ou conservatrice ?
Actualités Odonto-Stomatologiques 2008;241.
2- Nakamura N., Mitsuyasu T, Higuchi Y, Sandra F, Ohishi M.Growth characteristics of ameloblastoma involving the inferior alveolar nerve: a clinical and histopathologic study. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2001;91:557–62.
3- Hong J, Yun P.-Y,Chung I.-H, Myoung H,Suh J.-D, Seo B.-M,Lee J.-H et al. Long term follow upon recurrence of 305 ameloblastoma cases.Int J Oral Maxillofac Surg
2007;36:283-288.
4- Carlson ER, Marx RE.J Oral Maxillofac Surg. 2006 Mar;64(3):484-94.
5- Gardner DG. A pathologist's approach to the treatment of ameloblastoma. J Oral Maxillofac Surg. 1984 Mar;42(3):161
6- Adrian Ooi, Jiajun Feng, Hiang Khoon Tan, Yee Siang Ong Journal of Plastic, Reconstructive & Aesthetic Surgery Volume 67, Issue 4, April 2014, Pages 498–505.
7- Stephens A. Sachs,DDS.Surgical excisionwith peripheralostectomy:A definitive, yet conservative,approach to the surgicalmanagementof ameloblastoma.J Oral Maxillofac Surg 2006;64:476-483.
8- Bataineh AB. Effect of preservation of the inferior and posterior borders on recurrence of ameloblastomas of the mandible. Oral Surg Oral Med Oral Pathol Oral Radiol Endod2000;90:155–63.
9- Feinberg SE, Steinberg B. Surgical management of ameloblastoma.Current status of the literature. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 1996;81:383-8
10- Y. Jeblaoui, N. Ben Neji, S. Haddad, L. Ouertatani, S. HchichaAlgorithme de prise en charge des améloblastomes en Tunisie Rev Stomatol Chir Maxillofac 2007;108:419-423