W. EL KHOLTI, L. RHALIMI, S. BOUBDIR, J. KISSA
Service de Parodontologie
Faculté de Médecine Dentaire de Casablanca - Maroc
Université Hassan II
RÉSUMÉ
La gingivite ulcéro-nécrotique aigue (GUNA) est une forme sévère de maladies parodontales. Elle se caractérise par une apparition rapide des signes de nécrose de la gencive inter-dentaire, une douleur gingivale ainsi qu’un saignement gingival spontané. D’autres signes généraux tels que la fièvre, le malaise et les adénopathies peuvent être rapportés.
L’établissement d’un diagnostic rapide et exact permet d’éviter la survenue de complications.
Le traitement de la GUNA peut être organisé en plusieurs étapes. Les facteurs prédisposants doivent être pris en considération afin de garantir une stabilité des résultats. Nous rapportons un cas à travers lequel nous allons décrire l’approche diagnostique et le traitement de la GUNA.
INTRODUCTION
La gingivite ulcéro-nécrotique aigue est une forme sévère de maladies parodontales inflammatoires aigues. Elle se caractérise par une nécrose de la gencive inter-dentaire, des saignements gingivaux ainsi que la présence de douleurs gingivales (1). Étant donné que cette maladie est principalement observée chez le personnel militaire, il est difficile de déterminer sa prévalence exacte. Les études dans leur majorité, se sont concentrées en effet sur des populations de militaire et les prévalences rapportées ne peuvent pas être généralisées à l'ensemble de la population (2). La GUNA est définie par un ensemble de symptômes cliniques spécifiques, notamment l’œdème, le saignement et l’inflammation des papilles inter-dentaires. Ces papilles sont généralement recouvertes d’une couche blanchâtre avec un bord gingival ulcéré entouré d’un halo érythémateux. La lésion est limitée au tissu gingival et n’entraîne pas de perte d’attache (3).
L’halitose peut être détectée chez la majorité des patients. Des symptômes généraux comme la fièvre, une sensation de malaise et des lymphadénopathies peuvent être aussi rapportées (4).
Dans la classification des maladies et affections parodontales de 1999, une nouvelle catégorie de maladies parodontales sous le titre de maladies parodontales nécrosantes a vu le jour. Celle-ci regroupe à la fois la gingivite ulcéro-nécrotique et la parodontite ulcéro-nécrotique (5).
Plus récemment, dans la nouvelle classification du dernier Workshop de l’AAP /EFP tenu en 2017, le terme de gingivite ulcéro-nécrotique a été remplacé par le terme de gingivite nécrosante. En outre, les maladies parodontales nécrosantes ont été subdivisées en gingivite nécrosante, parodontite nécrosante et stomatite nécrosante en fonction de leur localisation (6).
Cet article rapporte la prise en charge d’une gingivite ulcéro-nécrotique associée au stress chez une patiente âgée de 21 ans.
CAS CLINIQUE
Une patiente âgée de 21 ans a été adressée au service de Parodontologie de la Faculté de Médecine Dentaire-Université Hassan II de Casablanca, Maroc. Elle se plaint de douleurs gingivales au niveau des incisives inférieures et des saignements gingivaux lors du brossage dentaire.
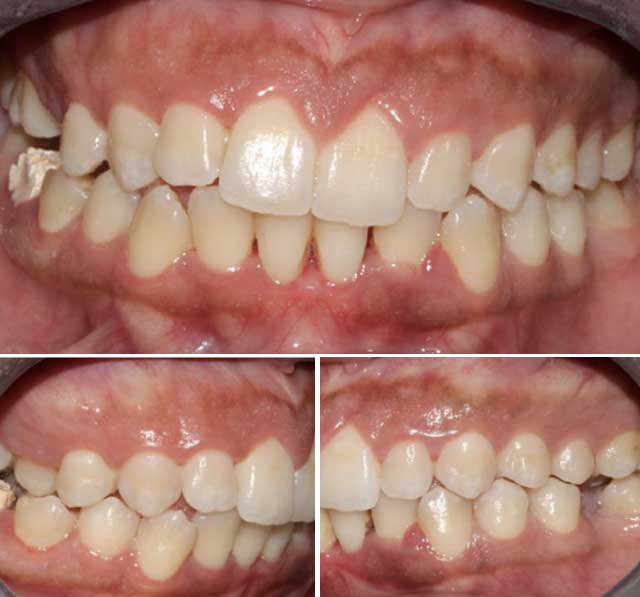
L’examen clinique a révélé une halitose, une nécrose ainsi qu’une ulcération des papilles inter-dentaires recouvertes d’une pseudomembrane. Une papille était absente au niveau du secteur incisif inférieure, avec une accumulation de plaque notée sur la surface des dents. Des dépôts importants de tartre ont été observés au niveau des molaires maxillaires droites ; Cela peut être expliqué par son habitude de mastication unilatérale (Fig 1).
|
Fig 1 : Vues cliniques initiales montrant la nécrose et l'ulcération des papilles inter-dentaires recouvertes d'une pseudomembrane. |
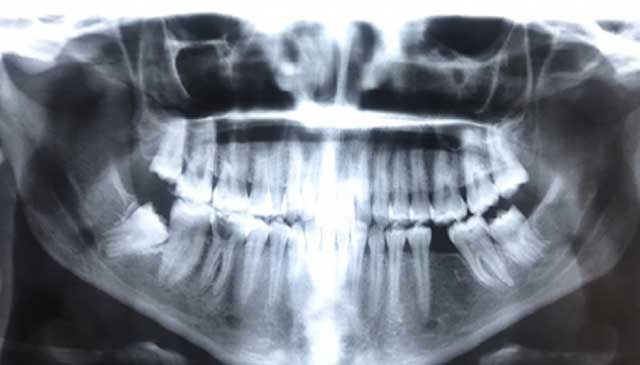
L’examen exobuccal a révélé la présence d’une adénopathie cervicale, malgré l’absence de toute affection systémique pouvant prédisposer la patiente à la GUNA. Cependant, cette patiente rapporte un stress psychologique probablement lié à ses études. L’examen radiographique n’a montré aucune perte osseuse inter-proximale (Fig2). Un test de dépistage du VIH a été effectué avec le consentement de la patiente et le résultat obtenu était négatif. Sur la base des données cliniques et radiologiques, nous avons posé le diagnostic d’une GUNA.
|
Fig 2 : Examen radiographique. |
En ce qui concerne le traitement d’urgence : après application de la Chlorhexidine 0,12%, un débridement supra gingival à l’aide d’instruments utrasoniques a été réalisé. Ensuite, une prescription d’antibiotiques à base de 500 mg de métronidazole 3 fois par jour pendant 7 jours a été faite. Le rinçage buccal par des bains de bouche à base de Chlorhexidine 0,12% associé au chlorure de Cétylpyridinium a été prescrit 2 fois par jour pour une durée de 15 jours. Les méthodes de brossage ont été aussi enseignées. Trois jours plus tard, un débridement sous gingival à l’aide d’instruments ultrasoniques a été effectué afin de désorganiser le biofilm bactérien et éliminer le tartre sous gingival. Grâce à l’amélioration des habitudes d’hygiène buccodentaire, l’état parodontal de la patiente s’est amélioré (Fig3).
|
Fig 3 : 3 mois après le traitement parodontal: diminution de l’inflammation gingivale. |
DISCUSSION
La gingivite ulcéro nécrotique aigue (GUNA) n’affecte que le parodonte superficiel. Cette maladie infectieuse est conditionnée par un ensemble de facteurs prédisposants qui altèrent la réponse immunitaire de l’hôte (1). De nombreux facteurs peuvent contribuer à la survenue de la GUNA, tels que le stress psychologique, les mauvaises habitudes alimentaires, le manque de sommeil, la consommation d’alcool, le tabac, une mauvaise hygiène buccodentaire, une gingivite préexistante ou une infection par le VIH. Ces facteurs semblent affecter la réponse immunitaire de l’hôte et favoriser la pathogenèse bactérienne (7).
Le stress psychologique peut altérer la microcirculation gingivale et réduire le flux salivaire. Il est responsable de l’altération de la réponse immunitaire à cause d’une augmentation des sécrétions de la corticosurrénale et de la modification des fonctions des leucocytes et des polynucléaires neutrophiles (8,9). De plus, il peut être responsable d’une augmentation de la prolifération bactérienne ainsi que de la sensibilité aux infections (9). Dans le présent cas, la patiente souffre d’un stress causé par ses études, ce facteur est un paramètre prédisposant à la GUNA.
Le diagnostic de la GUNA est établi cliniquement en fonction de la présence ou de l’absence de 3 signes cliniques importants : l’ulcération des papilles, le saignement gingival ainsi que la douleur gingivale (1). En effet, tous ces signes ont été décelés chez cette patiente. D’autres signes à savoir l’altération de l’état général comme la présence de fièvre, la sensation de malaise ainsi que les adénopathies ont été rapportés chez les patients atteints de la gingivite ulcéro-nécrotique (10). À l’examen clinique, nous avons noté la présence d’une haleine fétide ainsi qu’une adénopathie cervicale.
En ce qui concerne l’aspect histologique, l’observation du tissu gingival au microscope optique a montré la présence d’une ulcération au sein de l’épithélium pavimenteux stratifié et du tissu conjonctif entouré d’un tissu inflammatoire aigu non spécifique. Une étude au microscope électronique réalisée par Listgarten en 1965, a mis en évidence quatre zones associées à la lésion gingivale de la GUNA :
1. une zone bactérienne superficielle,
2. une zone riche en neutrophiles,
3. une zone nécrotique,
4. une zone d’infiltration par des spirochètes.
Des plasmocytes ont été retrouvés dans les parties les plus profondes, les Ig G et le facteur de complément C3 entre les cellules épithéliales. Ces observations ont été confirmées à l’aide d’une microscopie éléctronique ajoutant des zones de transition vers un stade d’inflammation chronique (11).
Le microbiote associé à la GUNA est composé de Treponeme sp., B. melaninogenicus ssp. Intermedius, Fusobacterium sp, Actinomyces. odontolyticus et les divers Selenomonas sp (12).
Selon le dernier workshop de l’EFP/AAP, d’autres types de bactéries ont été décrits comme responsables dans la pathogenèse de la GUNA. Les auteurs ont décrit une association de 4 bactéries à savoir P.intermedia, Treponema, Selenomonas et Fusobacterium (13).
Le diagnostic de la GUNA peut être confondu avec la gingivostomatite herpétique primaire, la gingivite desquamative, l'agranulocytose, la leucémie et la gingivite associée à une carence en acide ascorbique (10).
Le traitement de la GUNA doit être élaboré en plusieurs étapes. Ce traitement comprend la gestion de la phase aiguë, le traitement des anomalies consécutives à la maladie et la transition vers la phase de thérapie parodontale de soutien. La première phase vise à améliorer le confort du patient et à arrêter la destruction tissulaire. Elle repose sur un débridement ultrasonique de la plaque et du tartre superficiels ainsi qu'une oxygénothérapie (8). L'utilisation d'un bain de bouche à base de chlorhexidine à 0,12 % peut être recommandée deux fois par jour pendant 15 à 30 jours (14).
Les patients présentant une GUNA sévère ou modérée et une lymphadénopathie locale ou d'autres symptômes systémiques sont placés sous un régime antibiotique de pénicilline (500 mg toutes les 6 heures) et 250 mg de métronidazole toutes les 8 heures pendant 7 jours) (10). Le métronidazole est la molécule de choix en raison de son action contre les anaérobies (15). Les antibiotiques doivent être poursuivis jusqu'à ce que les complications systémiques disparaissent (10). Les facteurs prédisposants doivent être évalués et pris en considération. L'éducation des patients par renforcement des mesures d’hygiène est très importante afin de maintenir une bonne santé bucco-dentaire (10).
CONCLUSION
La GUNA est une maladie parodontale aiguë spécifique. Le diagnostic repose sur la présence de signes cliniques typiques, à savoir la nécrose des papilles, le saignement gingival et la douleur gingivale. Un traitement réussi doit être organisé selon plusieurs étapes. Les facteurs de risque doivent également être pris en considération afin d'éviter le développement ainsi que la récidive de cette maladie.
BIBLIOGRAPHIE
1. Rowland RW. Necrotizing ulcerative gingivitis. Ann Periodontol 1999;4:65‑73.
2. Melnick SL, Roseman JM, Engel D, Cogen RB. Epidemiology of acute necrotizing ulcerative gingivitis. Epidemiol Rev. 1988;10:191-211.
3. Martos J, Ahn Pinto KV, Feijó Miguelis TM, Cavalcanti MC, César Neto JB. Clinical treatment of necrotizing ulcerative gingivitis: a case report with 10-year follow-up. Gen Dent. 2019 May-Jun;67(3):62-65.
4. Shilpa Syam, T. N. Uma Maheswari. Guidelines for Clinical Management of patients with Acute Necrotizing Ulcerative Gingivitis : A Literature Review. Research J. Pharm. and Tech 2019; 12(8): 4027-4030.
5. Armitage, G.C. Development of a Classification System for Periodontal Diseases and Conditions. Ann Periodontol 1999;4 :1-6.
6. Holmstrup, P, Plemons, J, Meyle, J. Non–plaque-induced gingival diseases. J Clin Periodontol. 2018; 45( Suppl 20): S28– S43.
7. Malek R, Gharibi A, Khlil N, Kissa J. Necrotizing Ulcerative Gingivitis. Contemp Clin Dent. 2017 Jul-Sep;8(3):496-500.
8. Aaron SL, DeBlois KW. Acute Necrotizing Ulcerative Gingivitis. StatPearls. 2022.
9. Spector, A.M., Postolache, T.T., Akram, F. et al. Psychological Stress: A Predisposing and Exacerbating Factor in Periodontitis. Curr Oral Health Rep 7, 208–215 (2020).
10. Subair K and coll. Necrotizing gingivitis and periodontics an outlook. J Dental Sci Res Rep, 2022.
11. Listgarten, M.A. Pathogenesis of Periodontitis. J. Clin. Periodontol. 1986, 13, 418–430.
12. Loesche WJ, Syed SA, Laughon BE, Stoll J. The bacteriology of acute necrotizing ulcerative gingivitis. J Periodontol. 1982 Apr;53(4):223-30.
13. Herrera D, Retamal-Valdes B, Alonso B, Feres M. Acute periodontal lesions (periodontal abscesses and necrotizing periodontal diseases) and endo-periodontal lesions. J Periodontol. 2018 Jun;89 Suppl 1:S85-S102.
14. Martos J, Ahn Pinto KV, Feijó Miguelis TM, Cavalcanti MC, César Neto JB. Clinical treatment of necrotizing ulcerative gingivitis: a case report with 10-year follow-up. Gen Dent. 2019 May-Jun;67(3):62-65.
15. Herrera D, Alonso B, de Arriba L, Santa Cruz I, Serrano C, Sanz M. Acute periodontal lesions. Periodontol 2000. 2014;65:149–77.