L. BENRACHADI, OK. ENNIBI, D. BENAZZA, N. BENZARTI.
Service de Parodontologie
Faculté de Médecine Dentaire de Rabat
Université Mohamed V
RÉSUMÉ
L’Actinobacillus actinomycetemcomitans (Aa) est une bactérie hautement pathogène incriminée dans certaines formes de parodontites agressives notamment les parodontites juvéniles.
Cette haute pathogénicité est due à ses caractéristiques structurales, à ses interactions avec les défenses de l’hôte et à sa capacité de pénétrer les tissus parodontaux.
Toutes ces propriétés propres au Aa font que son élimination par un traitement conventionnel (curetage-surfaçage) est impossible, l’adjonction d’une antibiothérapie s’avère donc nécessaire. Cependant, vu la diversité de ses sérotypes et le nombre croissant de résistance à certains antibiotiques, le choix ciblé d’un antibiotique approprié par antibiogramme est souhaitable.
Mots clés : Actinobacillus actinomycetemcomitans, pathogénicité, élimination.
Les maladies parodontales sont des infections polymicrobiennes , mixtes , mais à prédominance anaérobies. Les travaux de Lœ (1965) (1) sur la gingivite expérimentale , ont démontré une relation de cause à effet entre l'augmentation quantitative de la plaque dentaire et l'apparition de la maladie parodontale : théorie non spécifique. Cependant, l'apparition de certaines formes de parodontites agressives, chez des patients ayant une hygiène buccale correcte, a fait admettre la notion de spécificité bactérienne. L'apparition de ces bactéries spécifiques dans la plaque est à l'origine des maladies parodontales.
Pour chacune des formes cliniques des parodontites actuellement reconnues, on peut énumérer certaines bactéries hautement pathogènes responsables de ces différentes entités. C'est ainsi que l’Actinobacillus actinomycetemcomitans est considéré comme l'agent étiologique majeur de la parodontite juvénile localisée. Cette bactérie est dotée d'un certain nombre de facteurs de virulence qui engendrent la lyse tissulaire, interfèrent avec la défense de l'hôte et inhibent la réparation tissulaire.
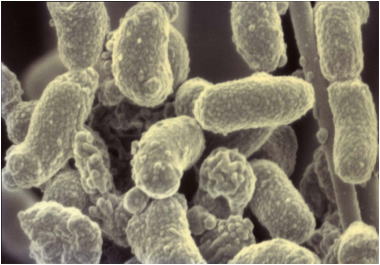
L’ACTINOBACILLUS ACTINOMYCETEMCOMITANS (Aa)
Description et différents types du Aa :
L’Aa est une bactérie gram négatif, non mobile, en forme de cocco-bacille de 0,7 ± 1µm de diamètre et 1 ± 0,4µm de long. L’étude biochimique du Aa révèle qu'elle est non hémolytique, microaérophile, capnophile et fermente la dextrine, le galactose, le maltose, le manitol et le xylose (2).
Sur la base de ces propriétés biochimiques, les auteurs ont distingué 10 biotypes (2).
Les sérotypes du Aa sont identifiés grâce à des antigènes de surface qui constituent une couche cellulaire externe. Les antigènes déterminant le sérotype peuvent être importants dans la colonisation bactérienne et l'inhibition du système de défense de l'hôte . Ces antigènes sont détectés grâce à la technique d'immunofluorescence indirecte (3). Ce qui permet de distinguer 5 sérotypes : a,b,c,d et e (4-5). Zambon et coll (1983) (3) ont essayé d'établir la relation entre ces sérotypes et la maladie parodontale.
Les sérotypes a et b sont les plus rencontrés dans la cavité buccale, alors que le sérotype c représente seulement 10% des isolats humains du Aa. Les sujets sains abritent une proportion des sérotypes a et c approximativement identiques. Alors que le sérotype b est retrouvé surtout chez les sujets atteints de parondontite juvénile localisée (PJL), suggérant ainsi que ce sérotype est particulièrement impliqué dans la pathogénicité de cette entité. Cette prédominance du sérotype b en cas de maladie est confirmée par d'autres études (6-7).
La coexistence de plus d'un sérotype chez un même individu est controversée . Certains auteurs ont rapporté qu'une personne atteinte n'affiche qu'un seul sérotype, et que l'infection par un sérotype persiste dans le temps, tout en protégeant le patient contre les autres sérotypes (8). Cependant, d'autres études ont rapporté deux sérotypes chez un même individu (9).
Les facteurs de virulence du Aa. :
Les facteurs de virulence du Aa lui confèrent une haute pathogénicité. Celle-ci est dûe à sa structure, à ses caractéristiques, à ses interactions avec les cellules de l’hôte ainsi qu'aux mécanismes associés à sa capacité d'adhésion et d'invasion cellulaire. Ces facteurs de virulence sont résumés dans ce qui suit:
- Les vesicules extracellulaires :
Il a été démontré par Lai et Coll (1981) (10) que des vésicules extramembranaires sont associées à la surface du Aa . Ces structures peuvent avoir deux activités complémentaires ; d’une part, ces vésicules contiennent des adhésines et donc permettent d'augmenter l'habileté de ces bactéries à adhérer à la surface des dents et des cellules épithéliales. D'autre part, elles contiennent généralement des leucotoxines, des endotoxines, et des bactériocines. Elles ont en plus une activité de résorption osseuse (11).
- La pénétration cellulaire :
L’Aa a la capacité de pénétrer dans les cellules épithéliales et de passer d’une cellule à une autre. Ceci lui permet d’atteindre le tissu conjonctif et les structures du parodonte profond : cément desmodonte, et os alvéolaire, où il va entraîner des altérations tissulaires.
- Les lipopolysaccharides (LPS) :
Les lipopolysaccharides sont des endotoxines secrétées par l’Aa. Ces LPS entraînent une résorption osseuse, soit directement soit indirectement en activant les macrophages. En effet, une fois stimulés, ces derniers produisent des interleukines (IL-1a, IL- 1ß), des facteurs de nécrose tissulaire et des protéines qui vont induire une inflammation tissulaire et une résorption osseuse (12).
- Bactériocines : actinobacillin :
L'actinobacillin est une bactériocine associée à la surface cellulaire et aux vésicules extracellulaires du Aa. Cet actinobacillin agit en augmentant la perméabilité des cellules bactériennes cibles. Cette augmentation de la perméabilité s'accompagne d'une fuite de DNA, de RNA et de macromolécules nécessaires à la croissance bactérienne (13). Ainsi, il a été démontré que l'actinobacillin inhibe la croissance de certains streptocoques et actinomyces, mais qu'il a peu d'effet sur la croissance des bactéries gram-négatives associées à la maladie parodontale.
- Collagenase :
Cette enzyme produite par le Aa agit sur le principal constituant de la matrice extracellulaire du parodonte qui est le collagène.
- Cytotoxine :
L’Aa produit une cytotoxine qui a un effet très toxique sur le fibroblaste , principale cellule du tissu conjonctif. Le fibroblaste est la source de la synthèse du collagène et du maintien de l’intégrité structurale du tissu parodontal. Ces manifestations sont observées au cours de certaines formes de maladies parodontales telle que la parodontite juvénile.
- Inhibiteur de la chimiotaxie des polymorphonucleaires :
Les neutrophiles polymorphonucléaires représentent la première et principale ligne de défense du parodonte. Toute perturbation ou inhibition de la chimiotaxie des cellules s’accompagne d’une aggravation de l’infection. Différentes études ont montré que l’Aa possède la capacité d’inhiber la chimiotaxie des polymorphonucleaires ce qui explique l’importance et la rapidité des lésions parodontales dans certaines formes de parodontites et notamment les parodontites juvéniles(14).
- Les proteines Fc-Bindings :
La fraction cristallisable (Fc) de l’immunoglobuline joue un rôle charnière qui permet de fixer le complément et les polymorphonucléaires. Des protéines binding Fc ou récepteurs de Fc ont été isolées dans le milieu infecté et /ou associées à la membrane externe de plusieurs souches du Aa, induisant ainsi une inhibition de la phagocytose. Tolo et Hegland (1991) (11) ont démontré que des molécules de surface de Aa associées à la matière capsulaire et secrétées dans le milieu extérieur peuvent se lier à la portion Fc de l’IgG et induire une inhibition de l’opsonisation des anticorps et des leucocytes polymorphonucléaires réduisant ainsi la phagocytose de 90%.
- La leucotoxine :
La leucotoxine est une succession de toxines qui possède une activité lytique spécifique. Cette leucotoxine est capable de se lier aux leucocytes, aux monocytes et aux lymphocytes.
Cette liaison s’accompagne de l’apparition de pores au niveau des cellules hôtes, il s’en suit une fuite des organelles intracytoplasmiques et donc la mort cellulaire.
Les gènes qui codent la synthèse de la leucotoxine du Aa sont désignés par ltx. Ces gènes sont au nombre de quatre et sont désignés dans l’ordre de transcription suivant : C, A, B et D.
Le gène qui détermine la structure de la leucotoxine est déterminé au niveau de la partie A.
C, B et D sont responsables de l’activation et du transport de toxines.
Toute altération au niveau du gène A va s’accompagner d’une perturbation de la synthèse de la leucotoxine. Ainsi, il a été démontré que la délétion de 350 paires de base (pb) à son niveau va entraîner une augmentation de l’activité leucotoxique (soit 10 à 20 fois) car le gène est incapable de régler la production de la leucotoxine(10-15).
LES PARODONTITES LIEES AU Aa
L’Aa a été impliqué dans l’étiologie de plusieurs parodontites. Il a même été détecté chez des sujets sains (16-17-18).
Ainsi l’Aa a été principalement incriminé dans l’étiologie de la parodontite juvénile avec une prévalence de 25 à 100% (tableau 1).
Le sérotype b serait plus prédominant dans les lésions parodontales de sujets atteints de cette entité.
L’Aa a été également isolé au niveau des parodontites à progression rapide, soit seul, soit en association avec d’autres germes tels que : porphyromonas gingivalis, prevotella intermedia et Eikenella corrodens (19).
Dans certaines formes de parodontites qui répondent mal au traitement conventionnel et qui sont dites parodontites réfractaires, l’Aa a été souvent isolé au niveau des sites actifs.
| AUTEURS |
ANNEE | PAYS | AGE (ANS) |
MOYEN D'ETUDE |
NOMBRE DE PATIENTS |
PREVALENCE DU Aa (sites) |
| EISENMAN (17) |
1983 | PANAMA | 14-19 | Culture | 12 (12sites) |
100% |
| ZAMBON (20) |
1983 | USA | 10-28 | Culture | 29 |
96,5% |
| KORNMAN (15) |
1985 | USA | 12-23 | Culture | 8 (11 sites) |
100% |
| ASIKAINEN (21) |
1986 | FINLANDE | 14-24 | Culture | 19 (38 sites) | 68% |
| ASIKAINEN (22) | 1987 | FINLANDE | 14-24 | Culture | 11 (22 sites) | 77% |
| CHUNG (23) |
1989 | KOREA | 18-33 | Culture | 16 | 75% |
| LOPEZ (24) |
1995 | CHILI | 15-28 | Culture | 10 (18 sites) | 44% |
| LOPEZ | 1996 | CHILI | 12-24 | Sonde ADN | 16 (36 sites) | 25% |
| Tableau 1 : Prévalence du Aa dans la PJL (d’après certaines études). |
L’ÉLIMINATION DU Aa
La parodontite juvénile localisée répond mal au traitement mécanique seul (26-27-28), car le Aa a la capacité de pénétrer dans les cellules épithéliales et de coloniser les tissus parodontaux en totalité autour des lésions. Cette insuffisance de traitement conventionnel pour éradiquer le Aa (28-29-30-31-32), justifie l’adjonction d’un traitement antibiotique pour traiter les patients atteints de cette entité pathologique (33-34).
Plusieurs antibiotiques ont été utilisés pour traiter les maladies parodontales associées au Aa.
Jusqu'à ces dernières années le chlorhydrate de tétracycline était le traitement de choix associé au débridement mécanique pour traiter les parodontites juvéniles, particulièrement dans le traitement non chirurgical (35).
Ces tétracyclines sont des agent bactériostatiques efficaces contre plusieurs germes gram négatifs incluant les pathogènes parodontaux comme le Aa.
Ceci peut être dû non seulement à leur action antibactérienne, mais aussi à un certain nombre de propriétés comme l’inhibition de la collagénase, l’action anti-inflammatoire, l’inhibition de la résorption osseuse, en plus de sa capacité de favoriser l’attache des fibroblastes à la surface radiculaire (36). Cependant, des problèmes de résistances sont de plus en plus rencontrés (28).
Plusieurs études ont rapporté que le traitement des maladies parodontales associées au Aa, donne de bons résultats lorsqu’on associe le Métronidazole à l’Amoxicilline (27-34-37-38-39-40-41). L’association de ces deux antibiotiques présente un effet synergique (28-32-40), très intéressant puisque le Aa secrète une ßlactamase qui lui confère une résistance aux ßlactamines.
Le résultat obtenu avec ces deux médicaments peut aussi être expliqué par le fait que l’association réduit la résistance aux antibiotiques (32). En effet, certaines études ont rapporté une résistance du Aa au Métronidazole seul (18-28). Saxen et Asikainen (1993) (42), ont évalué l’efficacité de l’administration du Métronidazole en comparaison avec celle de la Tétracycline pour la suppression du Aa et ont rapporté une meilleure efficacité du Métronidazole.
D’autre auteurs ont révélé que l’éradication du Aa par l’Amoxicilline plus le Métronidazole est obtenue pendant au moins 12 mois (38), avec une amélioration tant clinique que microbiologique de la maladie parodontale (37). Après cette période, une recolonisation peut avoir lieu (28-29-30), bien qu’elle ne soit pas toujours probable (43). Certains patients réinféctés , ont montré la présence d’autres souches du Aa, différentes de celles isolées au départ par PCR. Ceci laisse supposer que ces patients étaient infectés au début par différentes souches du Aa (43).
CONCLUSION
Le facteur étiologique principal des maladies parodontales reste bactérien. Certaines espèces bactériennes sont associées à des formes particulières de parodontites très agressives.
Le Aa est l’une des bactéries redoutables qu’on trouve dans les parodontites juvéniles. Ce Aa présente plusieurs sérotypes et de nombreux facteurs de virulence, d’où l’intérêt de rechercher des moyens de diagnostic microbiologiques faciles et fiables afin d’identifier le type de la souche à traiter. Ceci nous permettra de choisir le traitement antibiotique adéquat. Les patients peuvent ainsi bénéficier d’une meilleure approche thérapeutique.
BIBLIOGRAPHIE
1- LOE H.
Experimental gingivitis in man.
J. Periodontol., 1965 ; 36 : 177.
2- ZAMBON JJ.
Actinobacillus actinomycetemcomitans in human periodontal disease.
J. Clin. Periodontol., 1985 ; 12 : 1-20.
3- ZAMBON JJ.,SLOTS J.,GENCO J.
Serology of oral Actinobacillus actinomycetemcomitans and distribution in human periodontal disease.
Infect. Immun., 1983 ; 41(1) : 19-27.
4- ASIKAINEN S., CHEN C., SLOTS J.
Actinobacillus actinomycetemcomitans genotypes in relation to serotypes and periodontal disease.
Oral Microbiol. Immunol., 1995 ; 10 : 65-68.
5- GMUR R., MCNABB H., VANSTEENBERGEN TJM., BAEHNI P., VANWINKELHOFF AJ.
Seroclassification of hitherto non typeable Actinobacillus actinomycetemcomitans strains : evidence for a new serotype e.
Oral Microbiol. Immunol., 1993 ;8 : 116-120.
6- ASIKAINEN S., LAI C-H., ALALUUSIA S.,
SLOTS J.
Distribution of Actinobacillus actinomycetemcomitans serotypes in periodontal health and disease.
Oral Microbiol. Immunol., 1991 ; 6 : 115-118.
7- CALIFANO JV., SCHENKEIN HA., TEW JG.
Immunodominant antigenes of Actinobacillus actinomycetemcomitans serotype b in early-onset periodontitis patients.
Oral Microbiol. Immunol., 1992 ; 7 : 65-70.
8-SAARELA M., ASIKAINEN S., ALALUUSUA S.,
PYHALA L., LAI C-H.
Frequency and stability of mono- or poly-infection by Actinobacillus actinomycetemcomitans serotypes a-b-c-d or e.
Oral Microbiol. Immunol., 1992 ; 7 : 277-279.
9- YAMAMATO M., NISHIHARA T., KOSEKI T.,
ZHANG Y-J.
Prevalence of Actinobacillus actinomycetemcomitans serotypes in japanese patients with periodontitis.
J. Periodontol. Res., 1997 ; 32 : 676-681.
10- LAI C-H., LISTGARTEN MA., HAMMOND BF.
Comparative ultrastructure of leukotoxin and non-leukotoxin strains of Actinobacillus actinomycetemcomitans.
J. Periodontol. Res., 1981 ; 16 : 379-389.
11- TOLO K., HELGLAND K.
Fc.binding components : A virulence factor in Actinobacillus actinomycetemcomitans.
Oral Microbiol. Immunol.,1991 ; 6 : 373-377.
12- SAGLIE FR., SIMON K., MERRILL J., KŒFFLER HP.
Lipopolysaccharide from Actinobacillus actinomycetemcomitans stimulates macrophages to produce interleukin-1 and tumor necrosis factor mRNA protein.
Oral Microbiol. Immunol., 1990 ; 6 : 256-262.
13- HAMMOND BF., LILLARD SE., STEVENS RH.
A bacteriocin of Actinobacillus actinomycetemcomitans.
Infect. Immun., 1987 ; 55 : 686-691.
14- VANDYKE TE., BARTHOLOMEW E. , GENCO RJ. ,
SLOTS J., LEVINE MJ.
Inhibition of neutrophil chemotaxis by soluble bacterial products.
J.Periodontol., 1982 ; 53 : 502-508.
15- KORNMAN KS., ROBERTSON PB.
Clinical and microbiological evaluation of therapy for juvenile periodontitis.
J. Periodontol., 1985 ; 56 : 443-446.
16-ALALUUSUA S., ASIKAINEN S.
Detection and distribution of Actinobacillus actinomycetemcomitans in the dentition.
J. Periodontol., 1988 ; 59 : 504-507.
17-EISENMANN AC., EISENMANN R., SOUSA D.,
SLOTS J.
Microbiological study of localized juvenile periodontitis in Panama.
J. Periodontol., 1983 ;54 : 712-713.
18- VANWINKELHOFF AJ., TIJHOF CJ. , DEGRAAFF J.
Microbiological and clinical results of Metronidazole plus Amoxicillin therapy in A.actinomycetemcomitans associated periodontitis.
J. Periodontol., 1992 ; 63 : 52-57.
19- SLOTS J., FREIK D., RAMS TE.
Actinobacillus actinomycetemcomitans and Bacteroides intermedius in human periodontitis age relation ship and mutual association.
J. Clin. Periodontol., 1990 ; 17 : 659-662.
20- ZAMBON JJ., CHRISTERSSON LA., SLOTS J.
Actinobacillus actinomycetemcomitans in human periodontal disease : Prevalence in groups and distribution of biotypes with in families.
J. Periodontol., 1983 ; 54 : 707-711.
21- ASIKAINEN S., JOUSIMIES-SOMER H., KANERVO A., SAXEN L.
Actinobacillus actinomycetemcomitans and clinical periodontal status in finish juvenile periodontitis patients.
J. Periodontol., 1986 ; 57 : 91-93.
22- ASIKAINEN S., JOSIMIES-SOMER H., KANERVO A., SUMMANEN P.
Certains bacterial species and morphotypes in localized juvenile periodontitis and matched controls.
J. Periodontol, 1987 ; 58 : 224-230.
23- CHUNG MJ., CHUNG CP., SON SH.,
NISENGARD RJ.
Actinobacillus actinomycetemcomitans serotypes and leucotoxicity in korean localized juvenile periodontitis.
J. Periodontol., 1989 ; 60 : 506-511.
24- LOPEZ NJ., MELLADO JC., GIGLIO MS.,
LEIGHTON GX.
Occurrence of certain bacterial species and morphotypes in juvenile periodontitis in child.
J. Periodontol., 1995 ; 66 : 559-567.
25- LOPEZ NJ., MELLADO JC., LEIGHTON GX.
Occurrence of Actinobacillus actinomycetemcomitans, Porphyromonas gingivalis and Prevotella intermedia in juvenile periodontitis.
J. Clin. Periodontol., 1996 ; 23 : 101-105.
26- CHRISTERSSON LA., ALBINI B., ZAMBON JJ., WIKESJO UME., GENCO RJ.
Tissue localization of Actinobacillus actinomycetemcomitans in human periodontitis, light immunofluorescence and electron microscopy studies.
J. Periodontol, 1987 ; 58 : 529-539.
27- SLOTS J., ROSLING BG.
Suppression of the periodontopathic microflora in localized juvenile periodontitis by systemic tetracycline.
J. Clin. Periodontol., 1983 ; 10 : 465-486.
28- TINOCO EMB., BELDI MI., COMPEDELLI F.,
LANA M., LOUREIRO CA., BELLINI HT.
Clinical and microbiologic effects of adjunctive antibiotics in treatment of localized juvenile periodontitis. A controlled clinical trial.
J.Periodontol., 1998 ; 69 : 1352-1363.
29- HAFSTROM CA, WIKSTROM MB, RENVERT SN, DAHLEN GG
Effect of treatment on some periodontopathogens and their antibody levels in periodontal abscesses
J Periodontol.1994 ;65 : 1022-1028.
30- MANDELL RL., TRIPODI LS., SAVITT E.,
GOODSON JM., SOCRANSKY SS.
The effect of treatment on Actinobacillus actinomycetemcomitans in localized juvenile periodontitis.
J. Periodontol., 1986 ; 57 : 94-99.
31- RENVERT SN., WIKSTROM M., DAHLEN GG., SLOTS J., EGELBERG J.
On the inability of root debridment and periodontal surgery to eliminate Actinobacillus actinomycetemcomitans from periodontal pockets.
J. Clin. Periodontol., 1990 ; 17 : 351-355.
32- SLOTS J.
Actinobacillus actinomycetemcomitans and
Porphyromonas gingivalis in periodontal diseases.
Periodontol 2000, 1999 ; 20 : 353-362.
33- GJERMO P.
Chemotherapy in juvenile periodontitis.
J. Clin. Periodontol., 1986 ;13 : 982-986.
34- VANWINKELHOFF AJ., RODENBURG JP., GOENE RJ., ABBAS F., WINKEL EG.
Metronidazole plus Amoxicillin in the treatment of Actinobacillus actinomycetemcomitans associated periodontitis .
J. Clin. Periodontol., 1989 ; 16 : 128-131.
35- PALMER RM.
A double –blind bial of tetracycline in the managment of early onset periodontitis.
J. Clin. Periodontol., 1996 ; 23 : 670-674.
36- SEYMOUR RA., HEASMAN PA.
Tetracyclines in managment of periodontal diseases. A review.
J.Clin.Periodontol., 1995 ; 22 : 22-35.
37- BERGLUNDH T., KROK L., LILJENBERG B.,
WESTFELT E., SERIONO G., LINDHE J.
The use of Metronidazole and Amoxicillin in the treatment of advanced periodontal disease.A prospective controlled clinical trial.
J. Clin. Periodontol., 1998 ; 25 : 354-362.
38- FLMMIG TF., MILIAN E., KARCH H., KLAIBER B.
Differential effects of Metronidazole and Amoxicillin on Actinobacillus actinomycetemcomitans and
Porphyromonas gingivalis in intraoral habitats.
J. Clin. Periodontol.,1998 ;25 : 1-10.
39- LŒCHE WJ., GIORDANO JR., HUJŒL P., SCHHWARCZ J., SMITH BA.
Metronidazole in periodontitis : reduced need for surgery.
J. Clin. Periodontol., 1992 ; 19 : 103-112.
40- LOPEZ NJ., GAMONAL JA.
Effects of Metronidazole plus Amoxicillin in progressive untreated adult periodontitis : resultas of a single 1-week course after 2 and 4 months.
J. Periodontol., 1998 ; 69 : 1291-1298.
41- PAVICIC MJ., VANWINKELHOFF AJ.,
DOUCQUE NH., STEURES RW.
Microbiological and clinical effects of Metronidazole and Amoxicillin in Actinobacillus actinomycetemcomitans associated with periodontitis .A 2 year evaluation.
J. Clin. Periodontol., 1994 ; 21 : 107-112.
42- SAXEN L., ASIKAINEN S.
Metronidazole in the treatment of localized juvenile periodontitis.
J.Clin. Periodontol., 1993 ; 20 : 166-171.
43- VONTROIL-LINDEN B., ALALUUSUA S.,
WOLF J., JOUSIMIES-SOMER H., TORPPA J.
Periodontitis patient and the spouse : Periodontal bacteria before and after treatment.
J. Clin. Periodontol., 1997 ; 24 : 893-899.








