M. OULED BOUALLALA 1, A. GHARIBI 1, S. OUJDAD 2, J. KISSA 1
1- Service de parodontologie, Centre de Consultation et de Traitement Dentaire
2- Service de médecine orale, chirurgie orale, CCTD
Faculté de Médecine Dentaire de Casablanca
Université Hassan II - Maroc
RÉSUMÉ
Le lichen plan oral (LPO) est une affection auto-immune inflammatoire chronique dont la prévalence mondiale se situe entre 0,1 et 3,2 % (1). L'étiologie exacte du LPO n'a pas été nettement établie. Cette pathologie est considérée comme un processus multifactoriel. Le LPO est classé en différentes formes cliniques. Il affecte le plus souvent la muqueuse buccale, la langue et la gencive. Son diagnostic clinique se base en premier lieu sur la suspicion clinique qui devra être confirmée par l'examen anatomo-pathologique.
La prise en charge de cette affection repose surtout sur une mise en état de la cavité buccale et sur un traitement symptomatique permettant d’assurer un meilleur confort pour le patient. Un suivi régulier permet d’évaluer la progression de la pathologie et alerter devant tout signe de transformation maligne.
Mots clés : lichen plan oral, lichen plan cutanéo-muqueux, dermatose lichénoïde.
INTRODUCTION
Le lichen plan oral (LPO) est une affection auto-immune inflammatoire chronique médiée par les lymphocytes T. La prévalence mondiale de cette pathologie se situe entre 0,1 et 3,2 % (1). L’atteinte est plus fréquente pendant la quatrième-cinquième décennie de la vie et présente une prédilection feminine (1). La maladie se manifeste par des lésions réticulaires blanches accompagnées ou non de lésions érythémateuses, érosives, en plaques, bulleuses ou papuleuses (2). Les lésions buccales apparaissent généralement avant les lésions cutanées, elles sont le plus souvent asymptomatiques mais ces lésions ont peu tendance à régresser.
L’atteinte cutanée est par contre prurigineuse, elle évolue en général spontanément vers la guérison (3). Le LPO est considéré comme un trouble oral potentiellement malin, avec un taux de transformation maligne de 0,4 à 1,4 %. Bien que son étiologie soit inconnue, Le LPO est souvent en rapport avec un trouble immunitaire (4).
L’objectif de ce travail est de présenter une revue actualisée de la littérature sur le lichen plan, illustrée par des cas cliniques.
PHYSIOPATHOLOGIE
L’étiopathogénie du LPO n’est pas totalement élucidée. Deux hypothèses ont été proposées pour expliquer son développement :
- Soit une altération des kératinocytes, d’origine inconnue, avec libération ou formation d’antigènes entraînant une réponse immunitaire ;
- Soit une réaction immunologique primaire responsable de l’altération des kératinocytes et de leur apoptose.
Cette réponse immunitaire médiée par les lymphocytes T s’explique par le fait que les cellules présentant les antigènes et les kératinocytes de la couche basale pourraient être activées par l’un des facteurs de risque tels qu’une infection, des toxines bactériennes, des traumatismes mécaniques, un traitement systémique, une sensibilité de contact ou des agents non identifiés. Ces cellules une fois activées produiraient des chémokines qui attireraient et stimuleraient les lymphocytes, principalement des lymphocytes cytotoxiques CD8 et non cytotoxiques CD4. Les lymphocytes T CD8+ stimulées libèreraient du TNF α qui provoquerait l’apoptose des kératinocytes.
L’antigène présenté par les complexes majeurs d’histocompatibilité de types I et II pourrait être un peptide, ce qui confirmerait la nature auto-immune du LPO. Plusieurs éléments approuvent cette hypothèse : la chronicité de la maladie, l’association éventuelle avec d’autres maladies systémiques auto-immunes , l’âge et le sexe de prédilection, et la présence des cellules T autotoxiques (6,7).
FACTEURS DE RISQUE
L'étiologie exacte du LPO n'a pas été nettement établie. Cette pathologie est considérée comme un processus multifactoriel. En effet, plusieurs facteurs de risque sont associés au lichen plan, à savoir la susceptibilité génétique, les troubles endocriniens, ainsi que des facteurs psychologiques et traumatiques.
Le facteur génétique :
L’existence de rares cas de lichen plan familial et la surexpression de certains haplotypes HLA suggèrent que les facteurs génétiques ont un rôle dans la susceptibilité à développer cette maladie (8).
Les polymorphismes génétiques de plusieurs cytokines ont été associés à la présentation clinique du lichen plan familial. Il est caractérisé par une apparition précoce, un tableau clinique atypique et généralisé, et une forte tendance à devenir sévère et chronique (9).
Le niveau d'antioxydants et de peroxydation :
Plusieurs études ont dévoilé que chez les patients atteints du LPO, le niveau salivaire des produits de peroxydation comme le malonaldéhyde (MDA) et la 8-hydroxydéoxyguanosine (8-OHdG) augmentait et que celui des antioxydants tels que la vitamine C et E, diminuait par rapport aux individus sains. Cette diminution en taux d’antioxydants pourrait être un biomarqueur approprié pour prévoir les conditions précancéreuses comme le LPO (10).*
Les facteurs psychologiques tels que : stress, surmenage :
Les facteurs psychologiques peuvent jouer un rôle dans la pathogénèse du LPO.
Une revue systématique et méta-analyse menée par De Porras-Carrique T et al en 2022 a montré que les patients atteints de LPO souffrent d'une prévalence plus élevée de dépression, d'anxiété et de stress (11).
Selon Nosratzehi et al., 2014, le cortisol entraîne une réduction du nombre de lymphocytes et d'autres cellules immunitaires. Tout dysfonctionnement de l'axe hypothalamo-hypophyso-surrénalien chez les patients souffrant d'anxiété et de dépression entraîne une réduction de la sécrétion de cortisol sanguin et salivaire, et provoque des maladies affectant le système immunitaire comme le lichen plan oral (12,13).
L’association avec d’autres maladies systémiques :
Le LPO peut fréquemment être associé à de nombreuses maladies systémiques telles que le diabète sucré et l'hépatite. Ces dernières sont des dysfonctionnements métaboliques accompagnés de troubles du système immunitaire, et ont été considérées comme des maladies potentielles qui pourraient augmenter le risque de survenue du LPO.
Plusieurs études ont montré la présence d’une proportion significativement plus élevée de séropositivité au VHC chez les patients atteints de LPO (14).
D’autres ont considéré le LPO comme effet indésirable des médicaments utilisés pour traiter l'hypertension et/ou le diabète, on parle de syndrome de grinspan. Leur traitement médicamenteux est en effet capable de produire des réactions lichénoïdes de la muqueuse buccale (15).
Les traumatismes :
Le phénomène de Koebner: est un mécanisme par lequel les lésions du LPO se développent en réaction à un traumatisme mécanique. Il explique le développement des lésions du LPO dans les sites les plus fréquemment touchés par un traumatisme (la muqueuse buccale ou les surfaces latérales de la langue) (16). L’évolution prolongée du LPO peut s’expliquer par ce phénomène (17).
Les Réactions lichénoïdes orales OLR :
Ce sont des lésions buccales associées à la prise de médicaments, à une maladie systémique, ou à des allergies alimentaires ou aromatiques. Aussi, le contact direct des matériaux dentaires avec la muqueuse buccale entraine une modification de l’antigénicité des kératinocytes basales par la libération de mercure ou d'autres produits et aboutissent à une réaction immunitaire d'hypersensibilité retardée de type IV.
MANIFESTATIONS CLINIQUES
Le LPO est classé en différentes formes. Il affecte le plus souvent la muqueuse buccale, la langue et la gencive. La distribution des lésions buccales est toujours bilatérale et symétrique. Son évolution comporte des périodes de rechutes et de rémissions (17).
Les formes cliniques :
Forme réticulée :
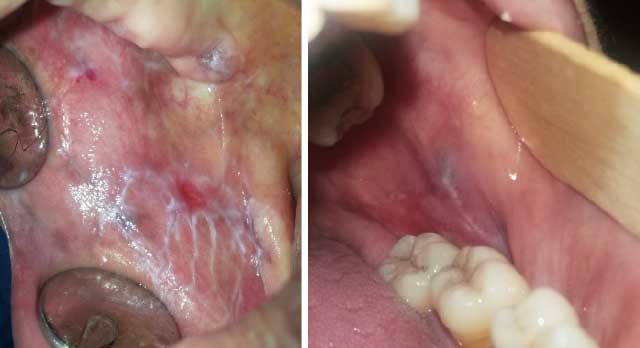
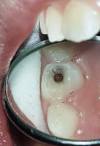
Forme la plus reconnue, elle est asymptomatique et correspond à la phase passive de la maladie. Elle forme un réseau de stries en dentelle appelées stries de Wickham (Fig.1).
|
Fig.1 : LPO réticulé (face interne de la joue). |
Forme érythémateuse :
L’érythème passe au premier temps et les lésions blanches sont en grande partie masquées ou visibles en filigrane. Le LPO érythémateux peut être confondu avec une stomatite ou une gingivite d’origine infectieuse (17).
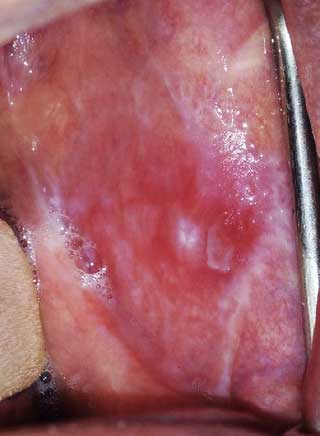
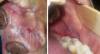
Forme érosive :
Elle correspond à une poussée aiguë. Elle se manifeste par des ulcérations étendues douloureuses, à contours irréguliers. Le patient gêné dans son alimentation et ses soins bucco-dentaires habituels, décrit des sensations de cuisson, un goût métallique, une irritation ou des saignements au brossage (Fig.2). Les traumatismes vont exacerber les lésions érosives suite au phénomène de Koebner.
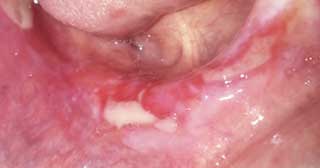
Forme bulleuse :
Elle se manifeste de façon exceptionnelle, le plus souvent dans la région jugale postérieure. Elle précède la forme érosive. La différenciation clinique entre les deux formes peut être difficile à établir. Elle se base sur la fréquente localisation gingivale, plus rare dans la forme érosive, et sur l’absence de sillon périphérique autour des érosions (18) (Fig.3).
Forme atrophique :
Elle apparaît après une période d’évolution, en phase tardive ou état post-lichénien. Cette forme présente un risque important de transformation maligne. Elle est caractérisée par une atrophie de l’épithélium qui pourrait la progression d’érosions suite à des traumatismes mineurs.
Cliniquement on observe une dépapillation symétrique définitive au niveau du dos de la langue, avec persistance de stries lichénoïdes ou d’une simple kératose d’épaisseur variable. Lors de la localisation jugale, la muqueuse change de couleur et perd son homogénéité.
|
Fig.2 : LPO érosif de la face interne de la joue.
|
Fig.3 : LPO bulleux sur la crête édentée.
|
|
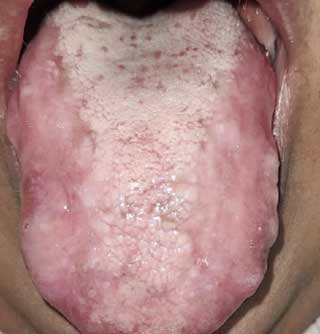
Fig.4 : LPO en plaque sur le dos de la langue. |
Forme en plaque :
Elle a une allure clinique semblable à une leucoplasie. On observe une lésion blanche, homogène, modérément surélevée, multifocale et lisse. Elle affecte la langue et la muqueuse buccale (Fig.4).
DIAGNOSTIC POSITIF
Le diagnostic clinique se base en premier lieu sur la suspicion clinique qui devra être confirmée par l'examen anatomo-pathologique.
Histopathologie :
L’examen anatomopathologique affirme le diagnostic et évalue l’activité et l’ampleur du LPO, dans un but thérapeutique et de suivi. Le siège de la biopsie doit être choisi avec soin, le prélèvement doit être fait en profondeur entre tissu sain et lésionnel.
Le diagnostic anatomopathologique nécessite l’association de trois signes caractéristiques: une parakératose ou hyperkératose, une dégénérescence vacuolaire du stratum germinatum, un infiltrat lymphocytaire en bande sous épithéliale (19).
Examens complémentaires :
a- L'immunofluorescence directe :
C’est une technique permettant la détection d'immunoglobulines (IgG, IgA, IgM ), de complexes immuns et de fractions du complément (C3) dans les tissus en utilisant des anticorps spécifiques combinés à de la fluorescéine et un microscope à fluorescence(20).
L’intérêt de l’immunofluorescence directe dans le diagnostic du LPO a été proposé par Kolde et al. (2003), particulièrement quand d’autres maladies auto-immunes sont suspectées (21).
C’est un test adjuvant utile dans le diagnostic du lichen plan, en particulier dans les cas atypiques.
Les données actuelles suggèrent que le lichen plan est une maladie immunitaire. Les cellules CD8+ cytotoxiques de l'épiderme lésionnel reconnaissent un antigène unique appelé antigène spécifique du lichen plan. Cet antigène a pu être mis en évidence par immunofluorescence indirecte en utilisant le sérum du patient et la peau lésionnelle autologue (22).
b-Test épicutané :
c’est une technique utilisée pour tester si une substance spécifique ( allergène) est capable de provoquer une réaction inflammatoire de la peau.
Les réactions lichénoïdes orales (OLR) associées aux matériaux dentaires aboutissent à une réaction immunitaire d'hypersensibilité de type IV/retardée. La réalisation de tests épicutanés est souhaitable, pour identifier avec certitude l’étiologie de ces OLR.
c-Typage HLA :
Pour certains cas de suspicion familiale, il peut être intéressant de demander un typage HLA .La surexpression de certains haplotypes HLA tel le HLA-DR1 suggère que la génétique joue un rôle dans la susceptibilité à développer le LPO (8).
DIAGNOSTIC DIFFÉRENTIEL
Le diagnostic différentiel du LPO se fait avec le muguet (ou candidose aiguë buccale).
Dans la forme réticulée, les lésions évoquent celles du lupus érythémateux, mais la présence de lésions cutanées permet généralement de faire la distinction entre les deux affections.
En outre la syphilis secondaire peut aussi ressembler cliniquement au lichen cutanéomuqueux.
Le diagnostic différentiel de la forme blanche kératosique exige d’abord de distinguer le lichen de toutes les autres causes de leucokératoses ou de leucoplasies.
En revanche, le diagnostic différentiel de la forme rouge inflammatoire est encore plus varié, cette lésion ne doit pas être confondue avec l’érythroplasie (23).
TRAITEMENT
Actuellement, on ne dispose pas d’un traitement curatif, ce qui explique le taux élevé de récidive et de transformation maligne après l’arrêt de la thérapeutique. Le traitement du LPO est symptomatique. Il est extrêmement important pour la qualité de vie du patient. La prise en charge thérapeutique dépend de la forme clinique. Le LPO asymptomatique implique une mise en état buccodentaire adéquate et un sevrage alcoolo-tabagique. De plus, pour le LPO symptomatique, son traitement consiste à éradiquer la douleur afin d’obtenir une rémission.
Des études récentes ont souligné des thérapies biologiques qui impactent le système immunitaire, et diminuent les symptômes du LPO comme : l'aloe vera topique ; le laser à faible intensité…etc (24).
Hygiène bucco-dentaire optimale :
L’amélioration de l’hygiène orale est primordiale dans le traitement du LPO. Le brossage peut être douloureux et génant dans le cas des lésions ulcératives et érosives. Du coup, l’accumulation de la plaque dentaire va aggraver l’inflammation intraorale et exacerber l’évolution du LPO (25,26).
Suppression des irritations locales :
Il faut minimiser les traumatismes chimiques et mécaniques ; tels que : les bords tranchants des obturations défectueuses ; les surfaces rugueuses mal polies ; et les prothèses mal adaptées.
Rôle de l’assainissement parodontal :
Les données de la littérature confirment la nécessité de la thérapie parodontale (conservatrice non chirurgicale) comme une étape indispensable dans le plan de traitement des manifestations gingivales du LPO. Un contrôle personnalisé efficace de la plaque sans influence traumatique sur les tissus gingivaux a permis une amélioration significative chez un grand nombre de patients (26).
Traitement des maladies générales :
Il est nécessaire de traiter toutes les maladies systémiques associées au LPO, qui pourraient aggraver la pathologie.
Le traitement médicamenteux : corticothérapie :
a- Topique :
L’administration topique ou intra-lésionnelle sera privilégiée pour les lésions érosives persistantes (moins d’effets secondaires).
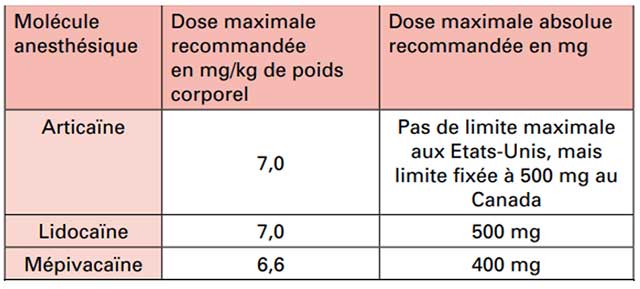
La lidocaïne visqueuse soulage les formes ulcéreuses érosives. La dose ne doit pas dépasser 200 mg (par exemple, 10 mL d'une solution à 2%) ou 4 mg/kg (chez les enfants) 4 fois/jour.
La pommade au tacrolimus à 0,1% appliquée 2 fois/jour peut induire une rémission durable, bien qu'elle n'ait pas été complètement évaluée.
Les patients qui appliquent le gel topique doivent sécher la muqueuse buccale avant l’application et éviter de manger et de boire pendant les 30 minutes qui suivent l’application afin de laisser un temps de contact suffisant avec la muqueuse buccale( 28).
Le lichen plan érosif buccal peut réagir à la dapsone, à l'hydroxychloroquine, ou aux collutoires ou bains de bouche à la cyclosporine (27).
L’un des effets secondaires de l’administration topique de corticoïdes est la candidose oro-pharyngée. Dans ce cas la prescription d’agent antimycosique s’impose (28).
b- Systémique :
L’administration systémique peut être indiquée lors d’atteinte cutanée concomitante et en cas d’échec du traitement local. Les médicaments prescrits sont :
- les corticostéroïdes oraux :
Par exemple, prednisone 20 mg 1 fois/jour pendant 2 à 6 semaines, suivis par une diminution progressive, peuvent être utilisés pour les cas graves (27).
- les rétinoïdes par voie orale :
Par exemple, acitrétine 30 mg 1 fois/jour pendant 8 semaines, sont indiqués dans les cas réfractaires (26).
- les inhibiteurs de la calcineurine :
La cyclosporine 1,25 à 2,5 mg/kg par voie orale 2 fois/jour peut être utilisée lorsque les corticostéroïdes ou les rétinoïdes échouent (27).
L’effet secondaire le plus fréquemment rapporté de l’utilisation des rétinoïdes et de la cyclosporine est une sensation de brulure transitoire, ce qui peut limiter son utilisation chez les patients souffrant d’un LPO érosif(28).
Les corticostéroïdes constituent le traitement de premier choix. Le clobétasol reste le plus efficace avec des taux de rémission allant jusqu’à 75% (Carrozzo et al. 2009) (29).
Les immunosuppresseurs comme le tacrolimus peuvent être utilisés comme traitement de deuxième classe. En cas d’atteinte intra- et extra-buccale, il est judicieux d’allier le traitement topique et systémique pour pouvoir éradiquer l’affection (24).
CONCLUSION
L’étiopathogénie du Lichen plan buccal demeure compliquée et relève de facteurs de risque multiples. Le diagnostic repose sur l’adjonction de signes cliniques et histopathologiques Actuellement, on ne dispose pas d’un traitement curatif de cette affection, mais un suivi régulier chez le dermatologue en collaboration avec le chirurgien dentiste est indispensable , afin d’évaluer la progression de la pathologie et alerter devant tout signe de transformation maligne.
BIBLIOGRAPHIE
1. Li C, Tang X, Zheng X, Ge S, Wen H, Lin X, Chen Z, Lu L. Global prevalence and incidence estimates of oral lichen planus: a systematic review and meta-analysis. JAMA Dermatol. 2020 doi: 10.1001/jamadermatol.2019.3797.
2. González-Moles MÁ, Ramos-García P, Warnakulasuriya S. An appraisal of highest quality studies reporting malignant transformation of oral lichen planus based on a systematic review. Oral Dis. 2020 doi: 10.1111/odi.13741
3. García-García V, Bascones Martínez A, Martinelli-Kläy CP, Alvarez Fernández E, Lombardi T, Küffer R. New perspectives on the dynamic behaviour of oral lichen planus. Eur J Dermatol 2012;22(2):172–7.
4. Wang D, Sandhu S, Woo SB. A guide for dental practitioners of common oral potentially malignant disorders. CDA J 2021;49.
5. Sugerman PB, Savage NW, Walsh LJ, et al. The pathogenesis of oral lichen planus. Crit Rev Oral Biol Med 2002 ; 13 : 350–65.
6. Mehrbani SP , Motahari P , Azar FP , Ahari MA . Role of interleukin-4 in pathogenesis of oral lichen planus : A systematic review . Med Oral Patol Oral C ir Bucal.2020 May 1 ;25 (3) :e410-e415.doi : 10.4317/medoral.23460.PMID :32134902
7. Calabrese C, Fabbri A, Benni M, Areni A, Scialpi C, Miglioli M, Di Febo G. Squamous cell carcinoma arising in esophageal lichen planus. Gastrointest Endosc 2003 ; 4 : 596-9.
8. Pan YX, Guo DW, Li X, Liu HY, Lu SL. [Gene polymorphism in oral lichen planus]. Hua Xi Kou Qiang Yi Xue Za Zhi. 2020 Dec 1;38(6):681-686. Chinese. doi: 10.7518/hxkq.2020.06.013. PMID: 33377347; PMCID: PMC7738920
9. Copeman PW, Tan RS, Timlin D, Samman PD. Familial lichen planus. Another disease or distinct people? Br J Dermatol 1978 ; 98 : 573-7
10. Rai B, Kaur J, Jacobs R, et al. Possible action mechanism for curcumin in pre-cancerous lesions based on serum and salivary markers of oxidative stress. J Oral Sci. 2010;52:251–6.
11. De Porras-Carrique T, González-Moles MÁ, Warnakulasuriya S, Ramos-García P. Depression, anxiety, and stress in oral lichen planus: a systematic review and meta-analysis.Clin Oral Investig. 2022 Feb;26(2):1391-1408. doi: 10.1007/s00784-021-04114-0. Epub 2021 Aug 30. PMID: 34460001
12. Nosratzehi T. Oral Lichen Planus: an Overview of Potential Risk Factors, Biomarkers and Treatments. Asian Pac J Cancer Prev. 2018 May 26;19(5):1161-1167. doi: 10.22034/APJCP.2018.19.5.1161. PMID: 29801395; PMCID: PMC6031815.
13. Nosratzehi T, Arbabi-Kalati F, Salimi S, et al. The evaluation of psychological factor and salivary cortisol and IgA levels in patients with oral lichen planus. ZJRMS. 2014;16:31–4.
14. S. Adnan, C.Mahad , S.Haitami, I.Benyahya, hepatitis C virus infection and oral lichen planus : a controversial association Elsevier 2022
15. P-J. Lamey BSc, BDS, MBChB, DDS, J. Gibson BDS , et al. grinspan’s syndrome : a drug-induced phenomenon ?; Elsevier 2005
16. xiaolin Zhang et al. Caracteristics and pathogenesis of Koebner phenomenon , experimental dermatology Wiley 2022
17. Kuffer R, Lombardi T, Husson-Bui C, Courrier B, Samson J. La muqueuse buccale : de la clinique au traitement, chapitre 7, Le lichen plan buccal. Paris éditions : MED’COM ; 2009.
18. Thorn JJ, Holmstrup P, Rindum J, Pindborg JJ. Course of various clinical forms of oral lichen planus. A prospective follow-up study of 611 patients. J Oral Pathol 1988 ; 17 (5): 213–218
19. C. GERBER et al. Le lichen plan gingival érosif : à propos de 3 cas ; actualités odonto-stomatologiques 2009
20. Sébastien Menzinger et coll , Immunofluorescence directe en dermatologie : principales indications ; Elsevier 2019
21. Kolde G, Wesendahl C, Stein H, Reichart PA. Oral lichen planus: diagnostic immunofluorescence testing on routine histological material. Br J Dermatol 2003 ; 148 (2) : 374-6.
22. Fei Mao et al,Direct immunofluorescence and immune function in patients with oral lichen planus, EMC ,2022
23. Bernard Delisle, le lichen plan des muqueuses ,Le Médecin du Québec, volume 49, numéro 4, avril 2014
24. Schenkel JS, Lübbers HT, Rostetter C, Metzler P. Traitement médicamenteux du lichen plan buccal. Swiss Dent J. 2017;127(6):538-539. French. PMID: 28639683
25. Albaghli F, Zhou Y, Hsu CC, Nibali L. The effect of plaque control in the treatment of Oral Lichen Planus with gingival manifestations: a Systematic Review. Community Dent Health. 2021 May 28;38(2):112-118. doi: 10.1922/CDH_00202Albaghli07. PMID: 33848405
26. Stone S. J., McCracken G. I., Heasman P. A., Staines K. S., Pennington M. Cost-effectiveness of personalized plaque control for managing the gingival manifestations of oral lichen planus: a randomized controlled study. Journal of Clinical Periodontology. 2013;40(9):859–867. doi: 10.1111/jcpe.12126.
27. Shinjita Das, MD, Harvard Medical School, Examen médical aout 2021 https://www.msdmanuals.com/fr/professional/troubles-dermatologiques/psoriasis-et-dermatoses-desquamantes/lichen-plan
28. Raj G, Raj M. Oral Lichen Planus. Updates 2023 Feb 6. In : StatPearls (internet). Treasure Island (FL) : StatPearls Publishing ;2023 Jan-,Available from : hppts://www.ncbi.nim.nih.gov/books/NBK578201
29. Carrozzo et al.: Oral lichen planus: a review. Minerva Stomatol. 2009; 58(10): 519–537.